
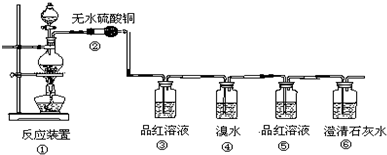
分析 (1)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;
(2)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水;
(3)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳;
(4)④装有酸性高锰酸钾,主要是氧化二氧化硫而除去二氧化硫;
(5)二氧化硫能够被溴水氧化生成硫酸和溴化氢,证明二氧化硫检验还原性;
(6)根据在没有二氧化硫的情况下能使澄清石灰水变浑浊,则可证明产物中一定有CO2气体.
解答 解:(1)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)验证碳和浓硫酸反应的产物需要先验证生成的水,则②处的现象是无水硫酸铜变蓝色说明生成水,
故答案为:无水硫酸铜变蓝色;
(3)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后再用品红试液检验是否除尽,最后用澄清石灰验证二氧化碳;所以第一次使用二氧化硫时的作用是检验是否有SO2生成,第二次使用二氧化硫的作用是检验SO2是否除净,
故答案为:检验是否有SO2生成;检验SO2是否除净;
(4)④装有酸性高锰酸钾,主要是氧化二氧化硫,避免对检验二氧化碳造成干扰,
故答案为:吸收二氧化硫;
(5)溴单质具有氧化性,二氧化硫能够被溴水氧化生成硫酸和溴化氢,反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr,该反应中二氧化硫表现了还原性,
故答案为:还原;SO2+Br2+2H2O=H2SO4+2HBr;
(6)根据第二次品红溶液不褪色,澄清石灰水变浑浊,说明二氧化硫没有了,则能使澄清石灰水变浑浊,则可证明产物中一定有CO2气体,
故答案为:第二次品红溶液不褪色,澄清石灰水变浑浊.
点评 本题考查了浓硫酸性质及其应用,题目难度中等,注意掌握二氧化硫、二氧化碳的性质及检验方法,明确检验顺序为解答关键,试题培养了学生的分析能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应热就是反应中放出的能量 | |
| B. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少 | |
| D. | 由C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1可知,石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
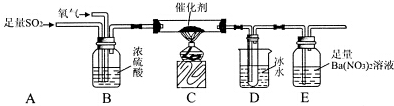
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: | |
| B. | CH4分子的比例模型 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 稀硝酸银溶液中滴加过量稀氨水,发生反应的离子方程式为Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10和C20H42 | B. | 邻二甲苯和对二甲苯 | ||
| C. | C4H8和C3H6 | D. | C2H2和C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
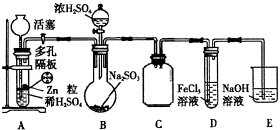
 硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>④>② | D. | ④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
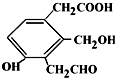 则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “四中子”不显电性 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com