
【题目】光气(COCl2),又称碳酰氯,常温下为无色气体,剧毒。化学性质不稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间体。氯仿(CHCl3)被氧化可产生光气2CHCl3+O2→2HCl+2COCl2。下列说法正确的是( )
A.CHCl3的立体构型为正四面体
B.COCl2为平面型分子,中心C原子采用sp2杂化
C.CHCl3和COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.CHCl3是手性分子,存在手性异构体
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤④为过滤,步骤⑤蒸发结晶
D. 步骤③用 CuCO3代替CuO也可调节溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是
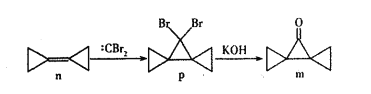
A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288}易溶于水,是一种很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如下图所示)
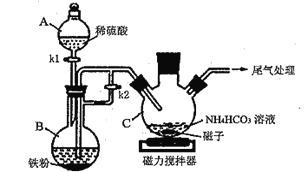
(1)仪器B的名称是__________________;实验操作如下:打开kl、k2,加入适量稀硫酸,关闭kl,使反应进行一段时间,其目的是__________________。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是____________,该反应产生一种常见气体,写出反应的离子方程式_________________________。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在____________的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是_________________________。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的结构和性质的叙述正确的是( )
A.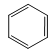 、
、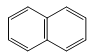 、
、 互为同系物
互为同系物
B.乙烯和聚乙烯均可使酸性高锰酸钾溶液褪色
C.苯分子的一个H原子被—C4H9取代后的产物共有4种
D.丙烷是直链烃,所以分子中3个碳原子在一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为_____;基态Cu+的核外电子排布式为_____。
(2)化合物(CH3)3N分子中N原子杂化方式为_____,该物质能溶于水的原因是_____。
(3)PH3分子的键角小于NH3分子的原因是_____;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为_____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
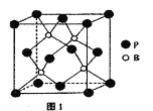
①在一个晶胞中磷原子的配位数为_____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体结构的说法不正确的是( )
A.图1,在金刚石晶体中,最小的碳环上有6个碳原子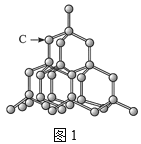
B.图2,在NaCl晶体中,与Na+距离最近且相等的Cl-形成正八面体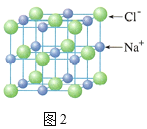
C.图3,在CaF2晶体中,Ca2+的配位数8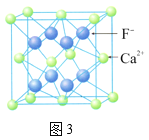
D.图4所示的金属晶体的堆积模型为面心立方最密堆积,其空间利用率为74% 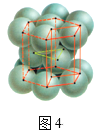
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.混合气体的密度不变
D.c(CO)=c(CO2)
E.化学平衡常数K不变
F.单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可采用如图所示的装置制备溴苯。其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。请回答下列问题:
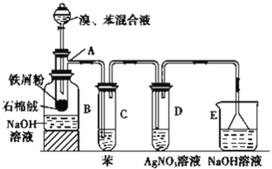
(1)写出A中生成溴苯的化学反应方程式________。
(2)试管C中苯的作用是_________。
(3)反应2 min~3 min后,在B中的氢氧化钠溶液里可观察到的现象是 ____。
(4)装置E中漏斗的作用是_____。
(5)能说明苯和液溴发生的是取代反应的现象是 ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com