
| A. | 乙烯的结构式C2H4 | B. | 正丁烷的结构简式CH3CH2CH2CH3 | ||
| C. | 四氯化碳的电子式 | D. | 苯的分子式 |
分析 A.乙烯分子中含有4个C-H键1个碳碳双键;
B.正丁烷主链有4个碳的烷烃;
C.四氯化碳的电子式中漏掉了Cl原子的3对未成键电子对;
D.分子式是用元素符合表示分子组成的式子;
解答 解:A.乙烯分子中含有1个碳碳双键,为平面结构,其结构式为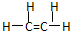 ,故A错误;
,故A错误;
B.正丁烷主链有4个碳的烷烃,结构简式为:CH3CH2CH2CH3,故B正确;
C.四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为 ,故C错误;
,故C错误;
D.苯的分子式为C6H6,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、结构简式、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:选择题
 近年来,科学家合成了一系列具有独特化学特性的(A1H3)n氢铝化合物.己知,最简单的氢铝化合物的分子式为A12H6,它的熔点为150℃,熔融不能导电,燃烧热极高. A12H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的(A1H3)n氢铝化合物.己知,最简单的氢铝化合物的分子式为A12H6,它的熔点为150℃,熔融不能导电,燃烧热极高. A12H6球棍模型如图.下列有关说法肯定错误的是( )| A. | A12H6是共价化合物 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | A12H6在空气中完全燃烧,产物为氧化铝和水 | |
| D. | A12H6中含有离子键和极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.086 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L、R形成的简单离子核外电子数相等 | |
| B. | 单质与浓度相等的稀盐酸反应的速率为Q>L | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | M与T形成的化合物既能与强酸反应又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH是氧化产物 | B. | 该反应电子转移数为2e- | ||
| C. | NaH为还原剂 | D. | H2O既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
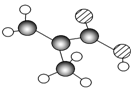 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学按如图所示的装置做实验,并记录实验情况.你认为框内叙述合理的是( )
某同学按如图所示的装置做实验,并记录实验情况.你认为框内叙述合理的是( ) | A. | ①②③ | B. | ③④⑤ | C. | ③④⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | 常温常压下,2.24L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com