
| A. | HCl | B. | NH3 | C. | CH4 | D. | CO2 |
分析 在水溶液或熔融状态下能够导电的化合物为电解质;气体通入水中能形成电解质,说明该气体能够与水反应生成能够电离的化合物,据此进行解答.
解答 解:HCl、NH3、CO2都与水反应,它们也都属于电解质,HCl溶于水完全电离,氨气溶于水反应生成一水合氨,一水合氨电离出离子导电,一水合氨是电解质,二氧化碳溶于水生成碳酸,碳酸能够电离出氢离子和碳酸氢根离子,所以碳酸、HCl、一水合氨为电解质,通入水中能形成电解质溶液的气体ABD,不能形成电解质溶液的气体是CH4满足题意,
故选C.
点评 本题考查了电解质与非电解质的判断,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确二氧化碳、氨气等不属于电解质,它们能够与水反应生成电解质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成反应、取代反应、消去反应 | NaOH醇溶液/加热、NaOH水溶液/加热、常温 |
| B | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| C | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
| D | 氧化反应、取代反应、消去反应 | 加热、NaOH醇溶液/加热、NaOH水溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
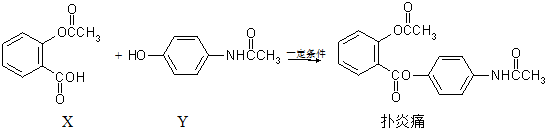
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度范围(℃) | 残留固体质量(g) |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: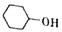 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
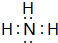 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下: +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$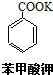 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O 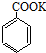 +HCl→
+HCl→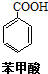 +KCl
+KCl| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com