
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取溶液体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中,需要使用的仪器除了烧杯,玻璃棒,还包括 。
③在配制过程中下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是 。
A.用量筒量取浓盐酸后用蒸馏水洗涤量筒,并把洗涤液转移入容量瓶中
B.配制过程动作过慢,浓盐酸中HCl挥发
C.溶液注入容量瓶前没有恢复到室温就进行定容
D.定容时俯视刻度线
E.定容时仰视刻度线
F.定容时不小心加水超过刻度线,立即用胶头滴管吸出使凹液面最低点与刻度线相切
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:填空题
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
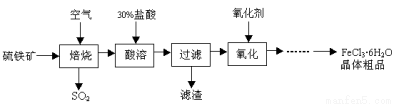
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。在25℃时,下列分析正确的是

A.使用该漂白剂的最佳pH为3
B.pH=5时,溶液中
C.pH=7时,溶液中含氯微粒的浓度大小为:
c(HClO2)>c( ClO2- )> c( ClO2) >c( Cl-)
D.NaClO2溶液加水稀释所有离子浓度均减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上第一阶段测化学试卷(解析版) 题型:选择题
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
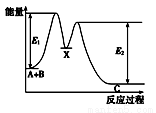
A.Ee表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列物质与水反应,能放出氧气的是
A.Na B. Na2O C. Na2O2 D.NO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:选择题
下列有关离子检验的说法不正确的是( )
A.检验Cl-的试剂是硝酸银和硝酸
B.检验SO42-的试剂是氯化钡和盐酸
C.滴加盐酸生成使澄清石灰水变浑浊的无色无味的气体,则该溶液含有CO32-或HCO3-
D.向溶液中加入氯化钡溶液后生成白色沉淀,即可证明有SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:选择题
下列各组物质分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SiO2 |
B | HBr | NaOH | Na2CO3 | CaO |
C | CO2 | NH3·H2O | NaHCO3 | CuO |
D | CH3COOH | KOH | KCl | HClO3 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期末化学试卷(解析版) 题型:选择题
已知4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.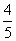 v(NH3)=v(O2) B.
v(NH3)=v(O2) B.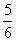 v(O2)=v(H2O)
v(O2)=v(H2O)
C.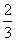 v(NH3)=v(H2O) D.
v(NH3)=v(H2O) D.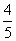 v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上期末考试化学试卷(解析版) 题型:填空题
下列各表述与示意图不一致的是
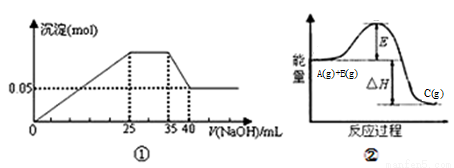
(1)图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量和NaOH的体积的关系图。则三种离子的物质的量之比为______________________;
图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C时,△H____0,若使用正催化剂,E值会_____________(增大、减小、不变)。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2O(g)充入容积为2L的密闭容器中合成CH3OH(g) ,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图.根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K=______________;升高温度,K值____________(填“增大”、“减小”或“不变”).
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ____________;
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的 1/2,达到新的平衡后,下列有关该体系的说法正确的是_________;
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是_________________;(写出相关的化学方程式并辅以必要的文字说明).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com