
| A. | ②③④ | B. | ③④⑤ | C. | ②④⑥ | D. | ②④⑤ |
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:NaH>H2O>H2S | D. | 硬度:SiC>石墨>CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的CO2在表面形成了溶液 | |
| C. | 最后变成碳酸钠粉末 | |
| D. | 该过程中的所有化学反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在氯气中燃烧,生成棕红色的烟 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
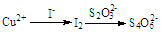
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,可用来干燥H2S | B. | 浓硫酸在常温下不与铁和铝反应 | ||
| C. | 可将蒸馏水注入浓硫酸进行稀释 | D. | 棉花接触浓硫酸后会变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
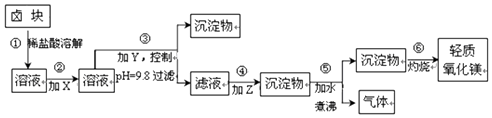
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| 资*源%库Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com