
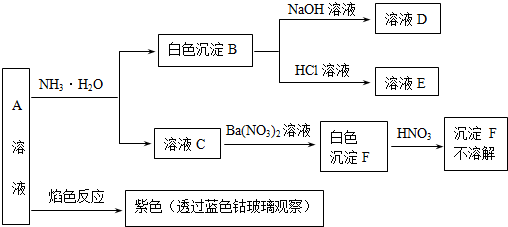
分析 A溶液焰色反应呈紫色,则A含有K+离子,A溶液与氨水反应生成的白色沉淀B既能与酸反应又能与均反应,则B为Al(OH)3,A中含有Al3+离子,D为NaAlO2,E为AlCl3,溶液C加入硝酸钡溶液得到白色沉淀F,再加入硝酸,白色沉淀F不溶解,故F为BaSO4,则A为(NH4)2Fe(SO4)2,据此解答.
解答 解:A溶液焰色反应呈紫色,则A含有K+离子,A溶液与氨水反应生成的白色沉淀B既能与酸反应又能与均反应,则B为Al(OH)3,A中含有Al3+离子,D为NaAlO2,E为AlCl3,溶液C加入硝酸钡溶液得到白色沉淀F,再加入硝酸,白色沉淀F不溶解,故F为BaSO4,则A为KAl(SO4)2.
(1)由上述分析可知,B为Al(OH)3,F为BaSO4,故答案为:Al(OH)3;BaSO4;
(2)沉淀B与盐酸反应的离子方程式为:Al(OH)3 +3H+═Al3++3H2O,
故答案为:Al(OH)3 +3H+═Al3++3H2O;
(3)由上述分析可知,盐A的化学式为:KAl(SO4)2,
故答案为:KAl(SO4)2;
(4)NaOH的物质的量为0.35L×1mol/L=0.35mol,0.1molKAl(SO4)2中含有0.1molAl3+,
Al3++3OH-=Al(OH)3 ↓
0.1mol 0.3mol 0.1mol
实验氢氧化钠为0.35mol-0.3mol=0.05mol,
Al(OH)3 +OH-═AlO2-+2H2O
0.05mol 0.05mol
故可以得到氢氧化铝为0.1mol-0.05mol=0.05mol,
故答案为:0.05.
点评 本题考查无机物推断,“焰色反应、白色沉淀B能与酸碱反应及白色沉淀不溶于硝酸”是推断突破口,熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
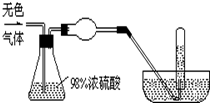 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com