
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省安溪一中高一下学期期末联考化学试卷(带解析) 题型:实验题
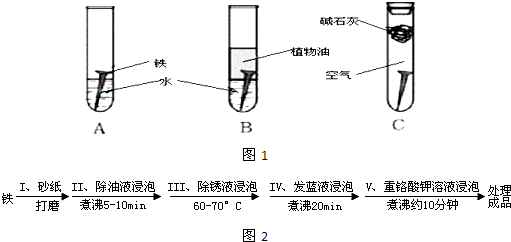
(14分)某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母);
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: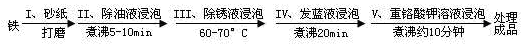
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南省玉溪一中高一下学期期末考试化学试卷(带解析) 题型:实验题
(14分)某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用
查看答案和解析>>
科目:高中化学 来源:2014届云南省高一下学期期末考试化学试卷(解析版) 题型:实验题
(14分) 某研究小组对铁生锈进行研究:

(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:

① 步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
② 为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③ 除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com