
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是
A.该反应达到平衡时,c(Mn2+)=c(Cu2+)
B.该反应达到平衡时,Ksp(CuS)较大
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)减小
D.该反应的平衡常数K=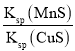
科目:高中化学 来源: 题型:
【题目】我国科学家已成功合成了一种碳纤维(3nm长的管状纳米管),这种碳纤维具有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的![]() )、熔点高、化学性质稳定的特点,因而被称为“超级纤维”。下列对碳纤维的说法不正确的是( )
)、熔点高、化学性质稳定的特点,因而被称为“超级纤维”。下列对碳纤维的说法不正确的是( )
A.它是制造飞机的理想材料
B.它的主要组成元素是碳
C.它的抗腐蚀能力强
D.碳纤维复合材料不易导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目合成过程如图所示。下列说法不正确的是

A.对二甲苯有 6 种二氯代物
B.可用溴水鉴别 M 和对二甲苯
C.异戊二烯所有碳原子可能共平面
D.M的某种同分异构体是苯酚的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
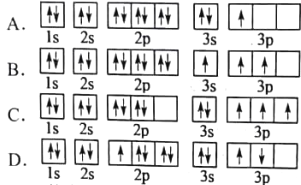
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
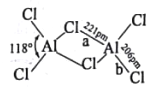
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
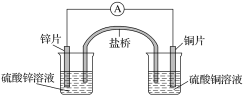
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
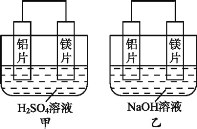
(1)写出甲中正极的电极反应式:____。
(2)乙中负极为__,总反应的离子方程式:___。
(3)由此实验得出的下列结论中,正确的有____。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极_____;
(2)碱式电池的电极反应:负极_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )
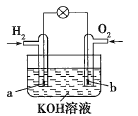
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D1、D2均为有机化合物,请根据图示回答问题.

(1)直链有机化合物A的结构简式是______________;
(2)①的反应类型是____________________;.
(3)②的反应类型是__________________;
(4)③的反应类型是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
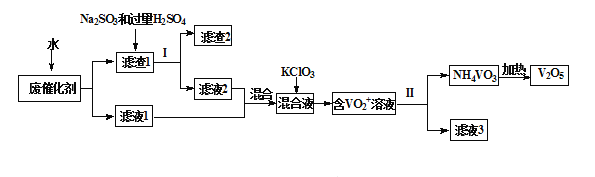
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
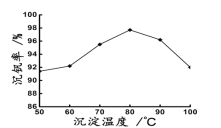
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol1)的质量分数是______。(列出计算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com