
【题目】结合元素周期表,完成下列问题。

(1)在元素周期表中全部是金属元素的区域为_____________。
a.A b.B c.C d.D
(2)I和II元素形成的化合物的化学式为_____,一定含有____键。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置__并写出甲单质与NaOH溶液反应的离子方程式____。
②甲、乙两元素中,金属性较强的是_____(填元素名称),可以验证该结论的实验是____(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分別和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
【答案】B Na2O2、Na2O 离子键 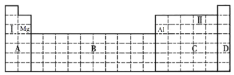 2Al+2H2O+2OH-=2AlO2-+3H2↑ 镁 bc
2Al+2H2O+2OH-=2AlO2-+3H2↑ 镁 bc
【解析】
(1)A区中氢元素为非金属元素,B区均为过渡元素,均为金属元素,C区中含有金属元素和非金属元素,D区均为稀有气体元素,故答案为:B;
(2)I为钠元素,II为氧元素,二者形成的化合物为Na2O2、Na2O,均为离子化合物,含有离子键,故答案为:Na2O2、Na2O;离子键;
(3)甲为短周期元素且甲元素的单质遇冷的浓硫酸会钝化,推知甲为铝元素,乙元素原子核外第三层与第一层上的电子数相等,即核外有12个电子,推知乙为镁元素。
①铝为第三周期IIIA族,镁为第三周期IIA族,在元素周期表中的位置为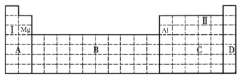 ,铝与氢氧化钠溶液反应的离子反应方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:
,铝与氢氧化钠溶液反应的离子反应方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为: ;2Al+2H2O+2OH-=2AlO2-+3H2↑;
;2Al+2H2O+2OH-=2AlO2-+3H2↑;
②根据元素周期律,同一周期从左到右金属性逐渐减弱,可知镁的金属性比铝强;
a.镁单质和铝单质在空气中久置后都会在表面形成一层氧化物膜,阻止金属与水发生反应,所以不能比较出金属性强弱,故a错误;
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应,反应越剧烈,其金属性越强,故b正确;
c.镁单质能和热水反应生成氢氧化镁,而铝单质几乎和热水不反应,滴加酚酞溶液,加入镁粉的溶液会呈浅 色,而加入铝粉的溶液中无明显现象,故c正确;
d.二者都为金属元素,不能通过比较氢化物的稳定性来判断金属性强弱,故d错误;
综上所述,答案为:镁;bc。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)根据如图所示的电解水原理进行实验,观察不同时间试管内的气体体积变化,则甲试管生成的气体是_______。

(2)假设电解了36g水,根据电解水的化学反应式计算生成氢气、氧气质量各为__________g;若在标况下,生成氢气、氧气体积各为_______________?
(3)根据实验观察和推算_______(“能”或“否”)得出初步结论:在相同温度和压强下,不同体积的O2和H2的其体积比等于其物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O![]() 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A. 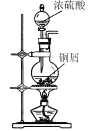 制备SO2
制备SO2
B. 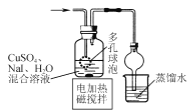 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液
C. 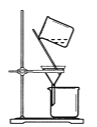 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
D. 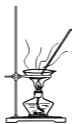 加热干燥湿的CuI固体
加热干燥湿的CuI固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
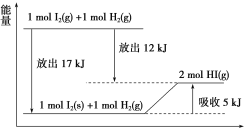
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各图均能表示甲烷的分子结构,按要求回答下列问题:

①上述哪一种更能反映其真实存在状况________ (填字母,下同)。
a.Ⅰ b.Ⅱ c.Ⅲ d.Ⅳ
②下列事实能证明甲烷分子是正四面体结构的是_____。
a.CH3Cl只代表一种物质 b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质 d.CCl4只代表一种物质
(2)烃分子中的碳原子与氢原子结合的方式是_____。
a.形成4对共用电子对
b.通过1个共价键
c.通过2个共价键
d.通过离子键和共价键
(3)乙烷的电子式为__________,分子式为CmH20的烷烃中m为________,分子式为C8Hn的烷烃中n为________,与CO2密度(同温同压)相同的烷烃分子式为____,若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是_____。
(4)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。
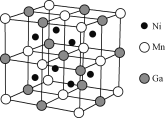
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
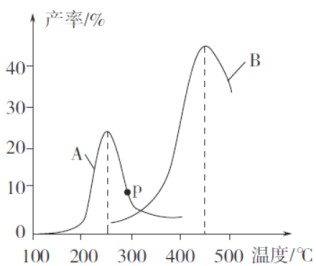
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学研究SO2和KI溶液的反应,设计如下实验。
实验 | 操作 | 现象 |
I |
| 溶液迅速变为浅黄色,将溶液进行离心分离无固体沉积, 加入淀粉溶液,不变色 |
II |
| 溶液立即变成深黄色,将溶液进行离心分离有浅黄色固体沉积,溶液黄色变浅,加入淀粉溶液,不变色 |
(1)加入淀粉溶液的目的是______,为达到相同的目的,还可选用的试剂是______。
(2)经检验,II中的浅黄色固体是硫。资料显示,在酸性条件下,SO2和KI溶液反应生成S和I2。
① 在酸性条件下,SO2和KI溶液反应的离子方程式是______。
② 针对II中加入淀粉溶液不变色,甲同学提出假设:______。为证实该假设,甲同学取II中离心分离后的溶液,加入盐酸酸化的BaCl2溶液,有白色沉淀生成。
③ 乙同学认为甲同学的实验方案不支持上述假设,理由是______。
④ 丙同学向1 mL 1 mol·L1 KCl溶液中加入5滴1 mol·L1盐酸,通入SO2,无明显实验现象,再加入盐酸酸化的BaCl2溶液,几乎没有白色沉淀。丙同学的实验结论是______。
(3)实验表明,I是SO2转化的催化剂。补全下列离子方程式。
SO2+H2O ===_____ + +
(4)对比实验I和II,推测增大H+的浓度可加快SO2的转化速率。为证实该推测,还需进一步进行实验证明,实验方案是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com