
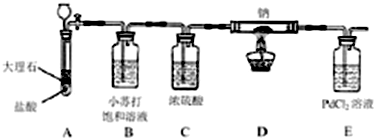
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 待反应完全后,将装置D中的残留固体加蒸馏水溶解. | 有黑色不溶物 | |
| 2 | 取①所得溶液上层清液加入过量BaCl2溶液 | 产物中有Na2CO3存在 | |
| 3 | - | 产物中有CO存在 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
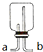 可连接在E处,则Cl2从
可连接在E处,则Cl2从
查看答案和解析>>
科目:高中化学 来源: 题型:
A、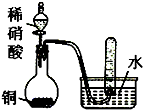 验证铜与稀硝酸的反应产物是NO |
B、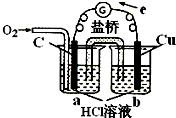 实现化学反应:2Cu+O2+4H+=2Cu2++2H2O |
C、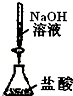 测定盐酸的浓度 |
D、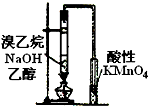 检验溴乙烷与NaOH醇溶液共热有乙烯生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、蒸馏、萃取 |
| B、蒸发、过滤、分液 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3 |
| B、FeCl3 |
| C、Fe2(SO4)3 |
| D、FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com