
(14分)图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
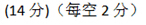

(3) 9 ; 变大
(4) 1 ; 234 ; 3
解析试题分析:(1)根据能量变化图,反应热等于生成物的总能量减去反应物的总能量,反应物和生成物能量的差值为E2-E1,写出化学方程式,标出各物质的状态,从而写出热化学方程式;(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据v=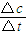 计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大;(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1; 令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ乙中吸收的热量为2n×234kJ=bkJ,整理得a+
计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大;(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1; 令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ乙中吸收的热量为2n×234kJ=bkJ,整理得a+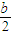 =234;丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
=234;丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
考点:热化学方程式的书写、化学平衡常数的计算、化学平衡的移动、等效平衡等知识。


科目:高中化学 来源: 题型:单选题
下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
| A.Na和O2 | B.NaOH和CO2 |
| C.Na2O2和CO2 | D.AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) 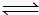 CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
(1)人们常用催化剂来选择反应进行的方向。下左图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。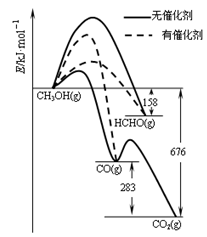
①在有催化剂作用下,CH3OH与O2 反应主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。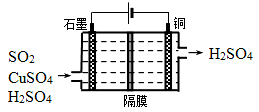
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(3分)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是
(填序号),写出反应⑥的化学方程式__ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: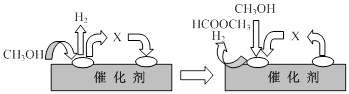
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。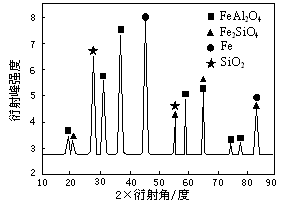
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。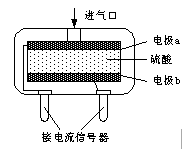
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)如右图所示,常温下电解5 min后,铜电极质量增加2.16g。
试回答: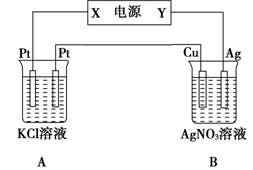
(1)电源电极X名称为_______(填“正极”或“负极”)。
(2)电解池B中阴极的电极反应式是__________。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
pH=_________(忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解完完全相同,应加入的物质是__________。
(4)已知在l0lkPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,则CH4完全燃烧的热化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示: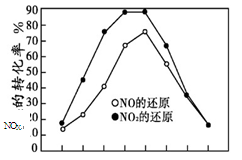
① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
 O2+Hb·CO K=220
O2+Hb·CO K=220查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com