


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室里要配制400mL0.2mol/L的硫酸钠溶液.实验步骤大致有:
实验室里要配制400mL0.2mol/L的硫酸钠溶液.实验步骤大致有:查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里要配制400mL0.2mol/L的硫酸钠溶液。实验步骤大致有:
A.在天平上称出___________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.把得到的溶液冷却后小心地沿着__________注入________mL的容量瓶中。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用_______________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
E.将瓶塞塞紧,充分摇匀。
 F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(1) 请填写上述空白处。
(2) 下列情况会使所配溶液浓度偏高的是___________(填序号)。
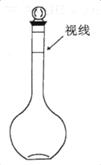
a.某同学定容时观察液面的情况如图所示
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.B操作时将少量液体洒到外面
e.容量瓶用前内壁沾有水珠
(3) 如果实验室用18mol/L的浓硫酸配制3. 6mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为___________mL,在实验时应用_________量取浓硫酸。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市正定中学高一(上)第一次月考化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com