
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
)________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是___________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________。
【答案】 Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水 小于 Ⅰ NH4Al(SO4)2溶液呈酸性,升高温度其水解程度增大,pH减小 103 mol/L a点 c(Na+)>c(
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水 小于 Ⅰ NH4Al(SO4)2溶液呈酸性,升高温度其水解程度增大,pH减小 103 mol/L a点 c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH)=c(H+)
)>c(OH)=c(H+)
【解析】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水;(2) NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是 NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比 NH4Al(SO4)2中的小,故填“小于”;(3)① NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;②由电荷守恒可得:20℃时,0.1 mol/L的NH4Al(SO4)2溶液中,c(
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中的悬浮颗粒使其沉降从而净化水;(2) NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是 NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比 NH4Al(SO4)2中的小,故填“小于”;(3)① NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;②由电荷守恒可得:20℃时,0.1 mol/L的NH4Al(SO4)2溶液中,c(![]() )+3c(Al3+)+c(H+)=c(OH-)+2c(
)+3c(Al3+)+c(H+)=c(OH-)+2c(![]() ),2c(
),2c(![]() )c(
)c(![]() )3c(Al3+)=c(H+)-c(OH-)=103 mol·L-1-1011 mol·L-1=103 mol·L-1。(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,a点相当于硫酸铵溶液,铵根离子水解促进水电离,b点c(H+)=c(OH-),c点含NH3·H2O,d点含NH3·H2O和NaOH,碱溶液抑制水电离,图中a、b、c、d四个点,水的电离程度最大的是a点;b点:根据物料守恒可得:c(SO42-)=c(NH4+)+c(NH3·H2O),则c(SO42-)>c(NH4+);由于溶液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(H+)+c(Na+ )+c(NH4+)=c(OH-)+2c(SO42-),所以c(Na+ )+c(NH4+)=2c(SO42-),结合c(SO42-)>c(NH4+)可知:c(Na+ )>c(SO42-),所以溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)。
)3c(Al3+)=c(H+)-c(OH-)=103 mol·L-1-1011 mol·L-1=103 mol·L-1。(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,a点相当于硫酸铵溶液,铵根离子水解促进水电离,b点c(H+)=c(OH-),c点含NH3·H2O,d点含NH3·H2O和NaOH,碱溶液抑制水电离,图中a、b、c、d四个点,水的电离程度最大的是a点;b点:根据物料守恒可得:c(SO42-)=c(NH4+)+c(NH3·H2O),则c(SO42-)>c(NH4+);由于溶液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(H+)+c(Na+ )+c(NH4+)=c(OH-)+2c(SO42-),所以c(Na+ )+c(NH4+)=2c(SO42-),结合c(SO42-)>c(NH4+)可知:c(Na+ )>c(SO42-),所以溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)。


科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 molL-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH 固体,lg![]() 随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
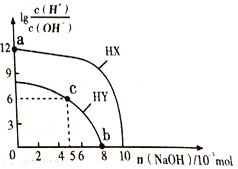
A. HX的酸性弱于HY
B. c点溶液中c(Y-)<c(HY)
C. a点由水电离出的c(H+)=10-12 molL-1
D. b点溶液中离子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度关系的叙述正确的是( )
A. 0.1 mol·L1 NH4NO3溶液中:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH)
)>c(H+)>c(OH)
B. 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO)=c(CO32)+c(HCO3)+c(H2CO3)
C. 向10 mL 0.2 mol·L1 NaCl溶液中滴入2 mL 0.1 mol·L1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(![]() )=c(Cl)>c(Ag+)
)=c(Cl)>c(Ag+)
D. 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的________极,Cu电极是________极,放电过程中电解液的密度________(填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是______________________________,该电极的电极产物共________g。
(3)Cu电极的电极反应式是______________________________,CuSO4溶液的浓度________(填“减小”“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
A.用锌粉代替锌粒B.滴入几滴硫酸铜溶液
C.改用5mol/L硫酸溶液D.改用冷的2mol/L硫酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com