
| 0.4 |
| 0.01 |
| 0.4 |
| 0.01 |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、氧化铁在涂料工业中用作红色防锈颜料 |
| B、铝制餐具不宜用来长时间存放酸性、碱性食物 |
| C、硅胶可用作袋装食品、瓶装药品等的干燥剂 |
| D、二氧化硫具有漂白性,可以用于食品增白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质子数、中子数均为1的核素:1H |
| B、漂白粉的有效成分的化学式:CaClO |
C、Cl-的离子结构示意图: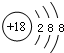 |
| D、碳酸钠的电离方程式:Na2CO3=2Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
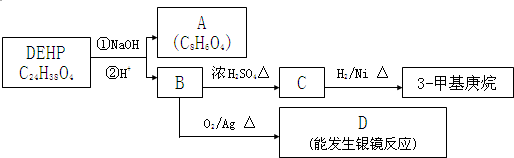
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.| 实验序号 | 消耗0.1032mol?L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com