
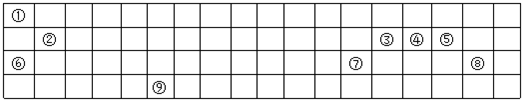
分析 根据元素在周期表中的位置可知:①为H,②为Be,③为C,④为N,⑤为O,⑥为Na,⑦为Al,⑧为Cl,⑨为Cr,
(1)①、③形成的 4 原子气态化合物C2H2;
(2)①H、④N和⑤O的电负性表示元素原子在分子中对成键电子的吸引能力;处于基态的气态原子失去一个电子生成+1价的气态阳离子所需要的能量称为第一电离能;
(3)②Be、⑥Na的最高氧化物对应水化物反应,Be和Al性质相似,所以反应是Be(OH)2和NaOH反应生成Na2BeO2和水;
(4)⑤为O,⑧为Cl形成的 3 原子分子中所有原子均达 8e-稳定结构,形成的是共价化合物ClO2,依据分子结构和成键方式分析判断;
(5)元素⑨的化合物 MO2Cl2、MCl3•6H2O,M 代表⑨为Cr元素,
①Cr元素为24号元素,位于第四周期第ⅥB族,周期表中的d区;
②铬原子最外层电子数为1;
③相似相溶原理分析判断;
④能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,根据硝酸银的物质的量计算配合物化学式中氯离子个数,再根据配位数确定內界,从而确定其化学式.
解答 解:根据元素在周期表中的位置可知:①为H,②为Mg,③为C,④为N,⑤为O,⑥为Na,⑦为Al,⑧为Cl,⑨为Cr,
(1)①、③形成的 4 原子气态化合物C2H2,分子中含两个C-H键为σ键,一个C≡C三键,其中含两个π键一个σ键,共含4个σ键,1个π键,
故答案为:4;1;
(2)①H、④N和⑤O的原子得到电子能力为⑤>④>①,①、④和⑤的电负性数值由大到小的顺序为⑤>④>①,②Mg和⑦Al的第一电离能和原子失去电子能力有关,越易失电子,电离能越小,②Mg和⑦Al的第一电离能数值由大到小的顺序为②<⑦,
故答案为:⑤>④>①;②<⑦;
(3)②Be、⑥Na的最高氧化物对应水化物反应,Be和Al性质相似,所以反应是Be(OH)2和NaOH反应生成Na2BeO2和水,反应的离子方程式为:Be(OH)2+2OH-=BeO22-+2H2O,故答案为:Be(OH)2+2OH-=BeO22-+2H2O;
(4)二氧化氯分子中氯原子和氧原子都是SP2杂化,氯原子一SP2(含有一对孤对电子)和氧原子一个空的SP2轨道形成一个σ单键,另外三个原子各有一个没有参加杂化的P轨道形成一个3中心5电子的离域大π键,因此二氧化氯分子是夹角略小于120度的折线型的构型,
故答案为:折线型;SP2;
(5)①Cr元素为24号元素,位于第四周期第ⅥB族,周期表中的d区,故答案为;d;ⅥB;
②与Cr同周期的所有元素的基态原子中,最外层电子数与Cr 原子相同的元素还有K、Cu,故答案为:K、Cu;
③MO2Cl2常温下为深红色液体,能与 CCl4、CS2等互溶,CCl4、CS2等都是非极性分子形成的溶剂,据此可判断 MO2Cl2是非极性分子,
故答案为:非极性;
④能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2mol•L-1×0.1L=0.2mol,0.1molCrCl3•6H2O和0.2mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是2,则有1个氯原子是配位原子,该配合物的配位数是6,所以有5个水分子是配体,则该配离子的化学式为[Cr(H2O)5Cl]2+,
故答案为:[Cr(H2O)5Cl]2+.
点评 本题考查了物质结构和性质、元素周期表、电子排布规律、配位数的判断的分析和判断等,题目难度中等,注意把握晶胞中该原子的配位数计算方法,熟悉周期表结构和规律是解题关键.


科目:高中化学 来源: 题型:推断题

 .
. .
. .
. .
. (写结构简式):
(写结构简式):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 18g 冰(图甲)中含 O-H 键数目为 4NA | |
| B. | 28g 晶体硅(图乙)中含有σ键数目为 2NA | |
| C. | 44g 干冰(图丙)中含有 NA个晶胞结构单元 | |
| D. | 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 将某有机物滴入高锰酸钾溶液中 | 高锰酸钾溶液褪色 | 该有机物一定含不饱和键 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向某淡黄色试液X中滴加少许NaOH溶液 | 试液X中出现红褐色沉淀 | 说明试液X中一定含有FeCl3 |
| D | 向装有少许无水硫酸铜的试管中加入乙醇 | 固体由白变蓝 | 该乙醇中一定含有水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
某温度下,反应SO2(g)+1/2O2(g)  SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为
2SO2(g) + O2(g)的平衡常数K2的值为
A.400 B.500 C.4×10-4 D.2.5×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
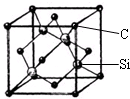 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com