
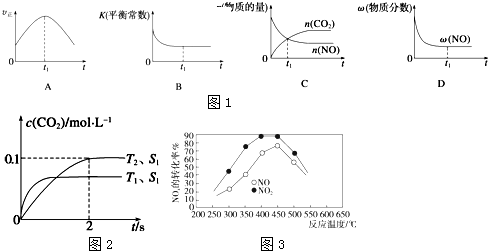
分析 (1)①由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
②接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
③A.到达平衡后正、逆速率相等,不再变化;
B.到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C.t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D.到达平衡后各组分的含量不发生变化;
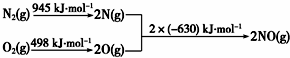
(2)①根据图2写出热化学方程式,利用甲烷燃烧热写出热化学方程式,根据1mol水蒸气变成液态水放热44kJ写出热化学方程式,再利用盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
②根据化学平衡移动影响因素判断;
(3)根据图象中氮氧化物的转化率变化趋势判断;根据图象中,两种氮氧化物转化率大小判断.
解答 解:(1)①由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=$\frac{0.1mol/L}{2s}$0.05mol/(L•s),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(L•s)=0.025mol/(L•s),
故答案为:0.025mol/(L•s);
②接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为 ,故答案为:
,故答案为: ;
;
③A.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,故B正确;
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD;
(2)①根据图2,旧键断裂吸收能量为:945+498=1443KJ/mol,放出能量为:2×630=1260KJ/mol,则热化学方程式为2NO=O2+N2△H=-1260+1443=183KJ/mol①;甲烷燃烧热为890kJ/mol,可写出热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l),△H=-890kJ/mol②;
H2O(g)=H2O(l),△H=-44kJ/mol③;由盖斯定律可知②+①×2-③×2,可得目标热化学方程式,则△H=-890kJ/mol+183/mol×2-(44kJ/mol)×2=-612kJ•mol-1,
故答案为:-612kJ•mol-1;
②A.增加原催化剂的表面积,同时加快正逆反应速率,化学平衡不移动,故A错误;
B.该反应△H<0,正反应方向放热,降低温度向正反应方向进行,可提高转化率,故B正确;
C.减小投料比,则相当于增大了甲烷浓度,可提高NO2转化率,故C正确;
D.反应前后气体体积之和相同,增大压强化学平衡不发生移动,故D错误;
故选:BC;
(3)在250℃-450℃时,NOx转化率随温度升高而增大,说明温度升高有利于反应的正向进行,推知反应未达化学平衡状态,升高温度加快反应速率,故转化率增大;450℃-600℃(温度较高)时,转化率降低,即升高温度,化学平衡向逆反应方向移动;
图象中不难看出相同温度下NO转化效率高于NO2的转化率,
故答案为:在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小;相同温度下NO转化效率比NO2的低.
点评 本题考查化学平衡图象、化学反应速率、影响化学平衡的因素、平衡常数计算等,题目综合性较大,较难,是对知识的综合利用、注意基础知识的理解掌握.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .②③ | B. | .②④ | C. | ①②③ | D. | .①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-m-n | B. | b+m-n | C. | b-m+n | D. | b+m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
| A. | SiCl4是分子晶体 | |
| B. | MgCl2中键的强度比NaCl中键的强度小 | |
| C. | 单质R可能是原子晶体 | |
| D. | AlCl3为离子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com