
 物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.
物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.分析 依据元素化合价和物质分类分析,X为气态氢化物为H2S,Y为硫元素的+4价氧化物为SO2,Z为+4价的盐可以为Na2SO3,W为+6价的含氧酸为H2SO4;
(1)上述分析可知X为硫化氢;Na2S2O3属于盐,S的化合价为+2价;
(2)根据二氧化硫的性质判断,二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
(3)W的浓溶液是浓硫酸溶液,与铜单质在加热条件下可以发生化学反应生成硫酸铜、二氧化硫和水;稀硫酸没有强氧化性.
解答 解:X为气态氢化物为H2S,Y为硫元素的+4价氧化物为SO2,Z为+4价的盐可以为Na2SO3,W为+6价的含氧酸为H2SO4;
(1)上述分析可知X为硫化氢;Na2S2O3属于盐,S的化合价为+2价,Na2S2O3应标在Z的下方,即 ;
;
故答案为:H2S; ;
;
(2)上述分析可知Y为二氧化硫气体,二氧化硫具有漂白性可以使品红溶液褪色,加热恢复红色,所以检验二氧化硫的试剂可以是品红溶液;二氧化硫是有毒气体会污染空气,溶于水显酸性,生成的亚硫酸易被氧化为硫酸,能形成酸雨;二氧化硫与氢氧化钠反应生成亚硫酸钠和水,其反应的离子方程式为:SO2+2OH-=SO32-+H2O;
故答案为:品红溶液;污染空气、形成酸雨;SO2+2OH-=SO32-+H2O;
(3)W的浓溶液是浓硫酸溶液,与铜单质在加热条件下可以发生化学反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;稀硫酸没有强氧化性,稀硫酸与金属反应是氢离子与金属发生置换反应,铜在金属活动性顺序中,铜的活动性没有氢强,所以Cu不与稀硫酸反应,由此可知,物质的浓度不同,性质不同;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;铜在金属活动性顺序中,铜的活动性没有氢强;物质的浓度不同,性质不同.
点评 本题考查了元素化合物的性质、氧化还原反应、反应产物和反应现象等,侧重于考查学生的分析能力和应用能力的考查,注意根据氧化还原反应的规律解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | “粉身碎骨浑不怕,要留清白在人间”只发生了物理变化 | |
| B. | “日照澄州江雾开”中伴有丁达尔效应 | |
| C. | “试玉要烧三日满,辨才须待七年期”中“玉”的成分是硅酸盐,该句诗表明玉的硬度很大 | |
| D. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3 | |
| B. | 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42- | |
| C. | 向SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 | |
| D. | 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 原文 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 水火既济而土和 |
| 解释 | 重结晶方法提纯物质 | 金属的置换 | 物质间转化的可逆性 | 黏土烧结成陶瓷 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=1 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
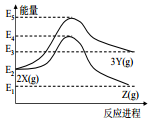
| A. | 由 X→Z 反应的△H<0 | B. | 由 X→Y 反应的△H=E5-E2 | ||
| C. | 增大压强有利于提高 Y 的产率 | D. | 升高温度有利于提高 Z 的产率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com