考点:原电池和电解池的工作原理,化学方程式的有关计算,物质的量浓度的相关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:计算题,基本概念与基本理论
分析:A、根据负极的电极方程和转移电子计算氧离子的物质的量;
B、由表达式可知,该密度=
;
C、氢氧化镁悬浊液中c(OH
-)=2c(Mg
2+);
D、向Mg-Cu混合物与足量的硝酸反应所得溶液中加入适量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合电子转移守恒判断.
解答:
解:A、负极的电极方程CH
4O+3O
2--6e
-=CO
2+2H
2O,则当原电池中有0.5 mol甲醇消耗时,负极消耗O
2-的物质的量为1.5mol,故A正确;
B、由表达式可知,该密度=
,溶液体积不等于氨气体积与水的体积之和,故B错误;
C、氢氧化镁悬浊液中c(OH
-)=2c(Mg
2+),则c(OH
-)=
mol/L,故C错误;
D、向Mg-Cu混合物与足量的硝酸反应所得溶液中加入适量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,若生成0.2mo1NO
2和0.1mo1N
2O
4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,故D错误.
故选A.
点评:本题考查了燃料电池的计算、Ksp的应用、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.



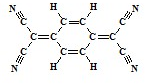 目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的为( )
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的为( )