
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】(1)①1s22s22p63s1或[Ne]3s1②Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
(4)Na+
(5)K2Cr2O7+3H2O2+ 4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O
【解析】试题分析:根据题意知M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层p轨道电子数是s轨道电子数的2倍,则M是O元素;R是同周期元素中最活泼的金属元素,且原子序数大于O,则R在第三周期,应是Na元素;X和M形成的一种化合物是形成酸雨的主要大气污染物,则X是S元素,进而知Y为Cl元素;Z的基态原子4s和3d轨道半充满,即价电子排布式为3d54s1,Z是Cr元素,据此作答。
(1)R是Na元素,原子序数为11,根据构造原理确定其基态原子的电子排布式为1s22s22p63s1或[Ne]3s1;S和Cl比较电负性较大的是Cl元素,答案为:1s22s22p63s1;Cl。
(2)H2S的沸点低于H2O的主要原因是水分子间形成氢键,使水的沸点升高,答案为:H2S分子间不存在氢键,H2O分子间存在氢键。
(3)SO3中硫原子的价层电子对数为3+(6-3×2)/2=3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形,答案为:平面三角形。
(4)根据晶胞结构可以算出白球的个数为8×![]() +6×
+6×![]() =4,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+,答案为:Na+。
=4,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+,答案为:Na+。
(5)根据题意知重铬酸钾被还原为Cr3+,则过氧化氢被氧化生成氧气,利用化合价升降法配平,反应的化学方程式为:K2Cr2O7+3H2O2+ 4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O ,
答案为:K2Cr2O7+3H2O2+ 4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O 。


科目:高中化学 来源: 题型:
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)该反应的离子方程式为 。
(2)用“双线桥”表示出反应中电子转移的方向和数目:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(3)氧化产物与还原产物的质量之比为 。
(4)如果反应中转移0.2mol电子,则生成I2的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届绵阳三诊】NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究。
【查阅资料】①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;
③2NaNO3![]() 2NaNO2+O2↑,NaNO2热稳定性很高。
2NaNO2+O2↑,NaNO2热稳定性很高。
【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:
(1)仪器a的名称是 ;干燥管D的作用是 。
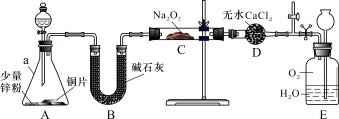
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是 。
(3)若无B装置,后果是 。
(4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是 。
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(5)提出假设:假设1. 白色固体只有NaNO2;假设2. 白色固体只有 ;
假设3. 白色固体是两种物质的混合物。
(6)实验验证:①要证明假设2是否成立,实验操作、现象和结论是____________________。
②为证明是假设1还是假设3成立,称取C中生成的白色固体a g置于坩埚中(坩埚质量为c g),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为b g,假设3成立时b-c的数字范围是 。(用含a的不等式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定为2L的密闭容器中,发生反应aA(g)+bB(g)![]() pC(g)△H=?。反应情况记录如下表:
pC(g)△H=?。反应情况记录如下表:

请仔细分析,根据表中数据回答下列问题:
(1)a= ____________,b= _______________, p=_____________。
(2)第2min到第4min内A的平均反应速率v(A)= _________ molL-1min-1。
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min:___________ ______或_____________;
②第6min ________________________;
③第8min _______________________ ;
(4)若从开始到第4min建立平衡时反应放出的热量为235.92kJ,则该反应的△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是 。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:_________。
a.汽车尾气中产生的NO:N2 + O2 ![]() 2NO。
2NO。
b.氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。
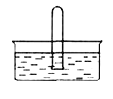
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作中正确的是
A. 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下
B. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
C. 用100ml量筒量取9.5 mL的液体
D. 焰色反应中,观察焰色后应趁热将铂丝插入到稀硫酸中,然后再次灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的H2,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中,羟基数之比为( )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:⑥ ⑨ 。
(2)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是 、 (用元素符号做答)。
(3)写出元素基态原子的价电子排布式 。
(4)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式: 。
(5)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该反应化学方程式 。
(6)在⑤与④中,设计简单的实验(只要写出实验方案即可),证明其金属性的强弱,方案 ;
(7)如何证明元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式 。
(8)在这些元素中VIIA氢化物的稳定性由强到弱 (用化学式做答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com