
分析 (1)先进行过量计算,根据不足量的物质计算生成氯化铝的质量;
(2)氧化铝有剩余,说明氢氧化钠完全反应,参加反应的氧化铝为10g-4.9g=5.1g,溶液质量为105.1g,根据Al原子守恒计算NaAlO2物质的量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(3)根据N原子守恒计算AlN的物质的量,再根据Al原子守恒计算参加反应Al2O3的质量,进而计算Al2O3的转化率;
(4)取出10mL溶液,加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g,说明含有SO42-;另取10mL样品,用慢慢滴加氨水至过量,最多可得到0.156g沉淀,沉淀为Al(OH)3,若改用氢氧化钠溶液直至过量,可收集到44.8mL的气体(标准状况),说明含有NH4+,计算硫酸钡、氢氧化钡、氨气物质的量确定NH4+、Al3+、SO42-的物质的量之比,再根据质量判断是否含有结晶水,进而确定化学式.
解答 解:(1)25.5g 氧化铝为$\frac{25.5g}{102g/mol}$=0.25mol,3.6g 碳为$\frac{3.6g}{12g/mol}$=0.3mol,4.48L(标准状态)氯气为$\frac{4.48L}{22.4mol/L}$=0.2mol,若0.2mol完全反应,则:
Al2O3+3 C+3 Cl2$\stackrel{高温}{→}$2AlCl3+3CO
0.067mol 0.2mol 0.2mol
氯气不足,故生成氯化铝为0.2mol×$\frac{2}{3}$×133.5g/mol=17.8g,
故答案为:17.8;
(2)氧化铝有剩余,说明氢氧化钠完全反应,参加反应的氧化铝为10g-4.9g=5.1g,溶液质量为100g+5.1g=105.1g,根据Al原子守恒,NaAlO2物质的量=$\frac{5.1g}{102g/mol}$×2=0.1mol,溶液体积V=$\frac{105.1g}{1051g/L}$=0.1L,所得溶液物质的量浓度为$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:1mol/L;
(3)生成氨气物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,根据N原子守恒,生成AlN的物质的量为0.15mol,根据Al原子守恒,可知参加反应Al2O3的质量为0.15mol×$\frac{1}{2}$×102g/mol=7.65g,则Al2O3的转化率为$\frac{7.65g}{10g}$=0.765,
故答案为:0.765;
(4)取出10mL溶液,加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g,说明含有SO42-,则n(SO42-)=n(BaSO4)=$\frac{0.932g}{233g/mol}$=0.004mol;
另取10mL样品,用慢慢滴加氨水至过量,最多可得到0.156g沉淀,沉淀为Al(OH)3,n(Al3+)=n[Al(OH)3]=$\frac{0.156g}{78g/mol}$=0.002mol,若改用氢氧化钠溶液直至过量,可收集到44.8mL的气体(标准状况),说明含有NH4+,则n(NH4+)=n(NH3)=$\frac{0.0448L}{22.4L/mol}$=0.002mol,10mL溶液中NH4+、Al3+、SO42-的总质量为0.004mol×96g/mol+0.002mol×27g/mol+0.002mol×18g/mol=0.474g<$\frac{6.9g}{10}$=0.69g,故还含有结晶水,含有结晶水的物质的量为$\frac{0.69g-0.474g}{18g/mol}$=0.012mol,
则n(NH4+):n(Al3+):n(SO42-):n(H2O)=0.002:0.002:0.004:0.12=1:1:2:6,故化合物X的化学式为:NH4Al(SO4)2•6H2O,
答:化合物X的化学式为NH4Al(SO4)2•6H2O.
点评 本题考查化学计算,侧重考查学生分析计算能力,是对学生综合能力的考查,难度较大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
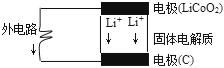 锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )
锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )| A. | 该电池的负极为LiCoO2 | |
| B. | 电池中的固体电解质可以是熔融的氯化钠、干冰等 | |
| C. | 充电时的阴极反应:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外电路上的“→”表示放电时的电子流向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH-)+c( HC2O4-) | |
| B. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| C. | NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
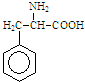 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
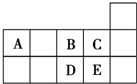
| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电池中电子由正极流出,经外电路流向负极 | |
| B. | 燃料电池两极板均发生氧化还原反应 | |
| C. | 燃料电池工作时,通常是将空气通向正极 | |
| D. | 化学电池的放电过程就是电能转化为化学能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com