
【题目】如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O. 
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了.
(1)写出乙醇制取乙烯的反应原理: .
(2)你认为哪个同学的观点正确?(填“甲”或“乙”),理由是(从下列选项中选) A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应
B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应
C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物
D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性
(3)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠?(填“可靠”或“不可靠”);理由是 .
(4)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量的洗气瓶,且将(Ⅱ)瓶中溶液换成 . 发生加成反应的化学方程式为 .
【答案】
(1)CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)乙;CD
(3)不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42﹣
(4)NaOH溶液;溴的四氯化碳溶液;CH2=CH2+Br2→CH2Br﹣CH2Br
【解析】解:(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,反应的化学方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O,所以答案是:CH3CH2OH
CH2=CH2↑+H2O,所以答案是:CH3CH2OH ![]() CH2=CH2↑+H2O;(2)浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,同时自身被还原成二氧化硫,二氧化硫与高锰酸钾反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4褪色,乙烯被高锰酸钾溶液氧化5CH2=CH2+12KMnO+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4 , 导致高锰酸钾溶液褪色;A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是二氧化硫与高锰酸钾反应,故A错误;B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是乙烯被高锰酸钾氧化,故B错误;C.能使高锰酸钾褪色的有二氧化硫和乙烯,所以不能证明通入的气体是纯净物,故C正确;D.无论是二氧化硫,还是乙烯,使高锰酸钾褪色,都是与高锰酸钾发生氧化还原反应,且高锰酸钾是氧化剂,气体是还原剂具有还原性,故D正确;所以答案是:乙;CD;(3)装置(Ⅱ)中装有经硫酸酸化的高锰酸钾溶液,酸化引入硫酸根离子,加入盐酸和氯化钡溶液,产生白色沉淀,不能说明是二氧化硫被高锰酸钾氧化所得, 所以答案是:不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42﹣;(4)氢氧化钠溶液可除掉二氧化硫,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应,
CH2=CH2↑+H2O;(2)浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,同时自身被还原成二氧化硫,二氧化硫与高锰酸钾反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4褪色,乙烯被高锰酸钾溶液氧化5CH2=CH2+12KMnO+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4 , 导致高锰酸钾溶液褪色;A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是二氧化硫与高锰酸钾反应,故A错误;B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是乙烯被高锰酸钾氧化,故B错误;C.能使高锰酸钾褪色的有二氧化硫和乙烯,所以不能证明通入的气体是纯净物,故C正确;D.无论是二氧化硫,还是乙烯,使高锰酸钾褪色,都是与高锰酸钾发生氧化还原反应,且高锰酸钾是氧化剂,气体是还原剂具有还原性,故D正确;所以答案是:乙;CD;(3)装置(Ⅱ)中装有经硫酸酸化的高锰酸钾溶液,酸化引入硫酸根离子,加入盐酸和氯化钡溶液,产生白色沉淀,不能说明是二氧化硫被高锰酸钾氧化所得, 所以答案是:不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42﹣;(4)氢氧化钠溶液可除掉二氧化硫,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应,
所以答案是:为除去二氧化硫气体,在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量NaOH溶液的洗气瓶,将装置(Ⅱ)换成盛有溴的四氯化碳溶液的洗气瓶,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应.反应的化学方程式CH2=CH2+Br2→CH2Br﹣CH2Br,
所以答案是:NaOH溶液;溴的四氯化碳溶液;CH2=CH2+Br2→CH2Br﹣CH2Br.


科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,X,Y,W,Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( ) ![]()
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<X
D.W,Z的氧化物都能与碱反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表述正确的是( )
A.质量数为16的氧原子: ![]() O
O
B.漂白粉的有效成分:NaClO
C.Mg2+结构示意图: ![]()
D.钠在氧气中燃烧的化学方程式:4Na+O2 ![]() 2Na2O
2Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下海带提碘的实验方案可以缩短实验时间,避免Cl2和CCl4的毒性.其实验流程如下: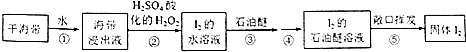
回答下列问题:
(1)步骤①的操作名称是;所需玻璃仪器有玻璃棒、烧杯和 .
(2)步骤②中加入H2O2后发生反应的化学方程式为;选择用H2O2做氧化剂的原因是 .
(3)检验I2的水溶液中含有单质碘的方法是,取样于试管中,加入淀粉,如溶液显色,则可证明含有碘单质.
(4)步骤③的操作名称是;石油醚能用作萃取剂,说明石油醚具有的性质是 .
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:

(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.常温下 ![]() =12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
C.含有大量Al3+的溶液中:Na+、Cl﹣、AlO2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( ) 
A.M﹣N间一定存在c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7溶液中有c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com