

| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1<T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 | D. | 反应Ⅳ:△H<0,T2<T1或△H>0,T2>T1 |
分析 反应Ⅰ:升高温度,A的转化率降低,平衡向逆反应移动,据此判断反应热效应;
该反应正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,根据压强对A的转化率影响判断压强大小;
反应Ⅱ:由图象可以看出T1>T2,升高温度C的物质的量减少;
反应Ⅲ:中温度的高低与温度对平衡移动的影响有关;
反应Ⅳ:由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,正反应为吸热反应△H>0,当T1>T2时,说明降低温度平衡向正反应方向进行,正反应为放热热反应△H<0.
解答 解:A.反应Ⅰ:升高温度,A的转化率降低,平衡向逆反应移动,所以正反应为放热反应,故△H<0,反应Ⅰ的特点是正反应方向为气体体积减小的方向,压强增大,平衡向正反应移动,A的转化率应增大,所以p2>p1,故A错误.
B.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,B错误;
C.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故C错误;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,正反应为吸热反应△H>0,当T1>T2时,说明降低温度平衡向正反应方向进行,正反应为放热热反应△H<0,故D正确.
故选D.
点评 本题考查外界条件对化学平衡的影响,题目难度中等,本题注意分析图象中曲线的变化趋势,结合方程式的特征以及外界条件对平衡移动的影响分析.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3→CO2→Na2CO3 | B. | Fe→FeCl2→FeCl3 | ||
| C. | SiO2→Na2SiO3→H2SiO3 | D. | Al2O3→A1(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-═CuS↓ | |
| D. | 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I-+O2═2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )| A. | 放电时,电子由钙电极流出 | |
| B. | 放电过程中,Li+向PbSO4电极移动 | |
| C. | 每转移0.2mol电子,理论上生成20.7gPb | |
| D. | 负极反应式:PbSO4+2e-+2Li+═Li2SO4+Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
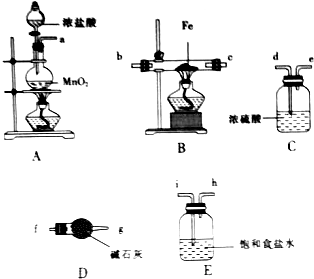 氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.某研究小组采用如图所示的装置制备少量纯净的氯化铁.
氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.某研究小组采用如图所示的装置制备少量纯净的氯化铁.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉遇碘水均显蓝色 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 乙烯与水在一定条件下反应生成乙醇 | |
| D. | 乙酸乙酯和葡萄糖均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气的主要成分是乙烯 | |
| B. | 天然气、沼气都属于可再生的清洁能源 | |
| C. | 石油的裂化和裂解都属于物理变化 | |
| D. | 煤干馏产生的煤焦油中含有芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com