
| A、试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 |
| B、盛Na2SO3、Na2S、KI溶液的试剂瓶不能用玻璃塞,贮存时应盖好瓶塞,防止被空气氧化 |
| C、金属镁着火可用干粉灭火器灭火,也可用泡沫灭火器灭火 |
| D、从硫酸铜溶液中获取硫酸铜晶体,可以用蒸发结晶,也可以用冷却结晶 |
| ||


科目:高中化学 来源: 题型:
 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10℃20mL3mol?L-1的X溶液 |
| B、20℃30mL2mol?L-1的X溶液 |
| C、20℃10mL4mol?L-1的X溶液 |
| D、10℃10mL2mol?L-1的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol |
| B、0.5mol |
| C、0.25mol |
| D、0.125mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
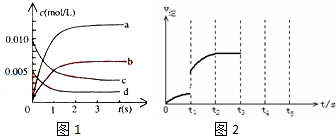
| 时间(S) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com