
 2Z(g);△H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L。下列说法正确的是 ( )
2Z(g);△H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L。下列说法正确的是 ( )| A.恒温恒容下,通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的1/3 |
| C.恒温下,扩大容器体积至原来的两倍,则X物质的量浓度大于0.4mol/L, |
| D.恒温恒压下,增加Z的物质的量,重新达平衡时,X物质的量浓度大于0.4mol/L |
科目:高中化学 来源:不详 题型:填空题
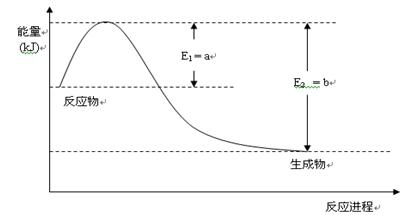
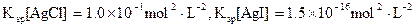 )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同种物质气态时熵值最大,固态时熵值最小 |
| B.体系越有序,熵值越小;越混乱,熵值越大 |
| C.与外界隔离的体系,自发过程将导致体系的熵减小 |
| D.25 ℃、1.01×105 Pa时,2N2O5(g)====4NO2(g)+O2(g)是熵增的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是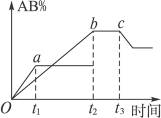
| A.AB为气体,A2、B2中必有一种为非气体;正反应吸热 |
| B.AB为气体,A2、B2中必有一种为非气体;正反应放热 |
| C.AB为固体,A2、B2中必有一种为非气体;正反应放热 |
| D.A2、B2、AB均为气体;正反应吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
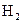 的总量,可采取的措施是( )
的总量,可采取的措施是( )A.加入少量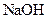 固体 固体 | B.加入少量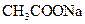 固体 固体 |
C.加入少量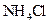 固体 固体 | D.加入少量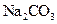 固体 固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2溶于水的反应 |
| B.氢气和氧气的反应 |
| C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O |
| D.实验室加热二氧化锰和浓盐酸的混合物制取氯气的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对反应2AgNO3+Cu=2Ag+Cu(NO3)2,给体系增大压强 |
| B.双氧水中加入少量氯化铁溶液 |
| C.在空气中燃着的木条插入盛有纯氧的瓶中 |
| D.用煤粉代替煤块燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com