
 2H2(g)+O2(g)�����Զ����������Ǹ����о�����Ҫ�ȵ㡣����Ϊ�����о�����������
2H2(g)+O2(g)�����Զ����������Ǹ����о�����Ҫ�ȵ㡣����Ϊ�����о����������� | A��Ѱ�Ҹ���Ļ�ʯȼ�ϣ�ȼ�ղ�������ʹˮ�ֽ����H2 |
| B���跨��̫����۽����������£�ʹˮ�ֽ����H2 |
| C��Ѱ�Ҹ�Ч���ʵĴ������ڽ�����������ʹˮ�ֽ����H2 |
| D��Ѱ������Ļ�ѧ���ʣ����ڿ���������Դ���Էֽ�ˮ��ȡH2 |
 ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A����Ӧǰ������Һ���¶� | B����Ӧǰ������Һ������ |
| C����Ӧǰ����������Һ���¶� | D����Ӧǰ����������Һ������ |
| ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
| ���� | �������� | �����Һ | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��п�����ᷴӦ��ȡ���� | B������������̼���������̼�ķ�Ӧ |
| C����������ʯ��ʯ | D��Ba��OH��2��8H2O������NH4Cl���巴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ���������������⣬һ�������������仯 |
| B����Ҫ���Ȳ��ܷ����ķ�Ӧ��һ�������ȷ�Ӧ |
| C���ʱ�ķ����ǡ�H����λ��kJ/mol����Ӧ�ȵĵ�λ��kJ |
| D����ѧ��Ӧ��ʵ���Ǿɼ����Ѻ��¼����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���κ�һ����ѧ�仯�Ĺ����ж������������ı仯 |
| B����ѧ�仯�����������仯��ʵ�ʾ��Ǿɼ�����Ҫ�����������¼����ɻ�ų����� |
| C�����������������ȷ�Ӧ��������ߣ���÷�ӦΪ���ȷ�Ӧ |
| D���粻�ر�ע������ѧ��Ӧ�ķ�Ӧ�Ⱦ��Ǿ��Ǹ÷�Ӧ���ʱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
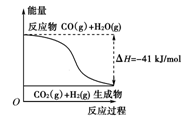
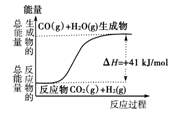
| A�����Ȼ�ѧ����ʽΪ��CO(g)��H2O(g)===CO2(g)��H2(g)������H����41 kJ/mol |
| B���÷�ӦΪ���ȷ�Ӧ |
| C���÷�ӦΪ���ȷ�Ӧ |
| D����H2OΪҺ̬ʱ���䷴Ӧ��ֵС��41 kJ/mol |
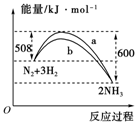
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH3OH��l��+3/2O2��g��===CO2��g��+2H2O��l����H=��725.8 kJ/mol |
| B��2CH3OH��l��+3O2��g��===2CO2��g��+4H2O��l����H=��1452 kJ/mol |
| C��2CH3OH��l��+3O2��g��===2CO2��g��+4H2O��l����H=��725.8 kJ/mol |
| D��2CH3OH��l��+3O2��g��===2CO2��g��+4H2O��l����H=��1452 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com