
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
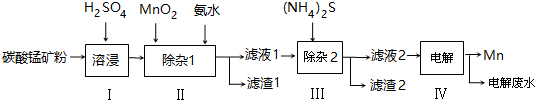
分析 向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰,以此解答该题.
解答 解:(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等,
故答案为:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,
故答案为:Fe(OH)3;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Co2+、Ni2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失,
故答案为:若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1,
故答案为:5:1;
(5)滤渣1为为Fe(OH)3,质量为c kg,则n(Fe3+)=n(Fe(OH)3)=$\frac{1000c}{107}$mol,由2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O可知n(MnO2)=$\frac{1}{2}$×$\frac{1000c}{107}$mol,
将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg,n(Mn)=$\frac{1000b}{55}$mol,
可知n(MnCO3)=$\frac{1000b}{55}$mol-$\frac{1}{2}$×$\frac{1000c}{107}$mol,
m(MnCO3)=($\frac{1000b}{55}$mol-$\frac{1}{2}$×$\frac{1000c}{107}$mol)×115g/mol,
则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%,
故答案为:$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.
点评 本题考查了制备方案的设计,为高考常见题型,题目难度中等,根据制备流程明确制备原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
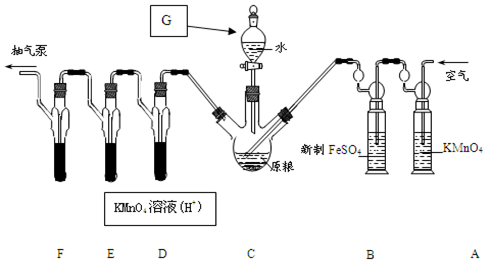
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
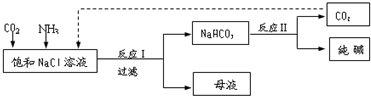
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
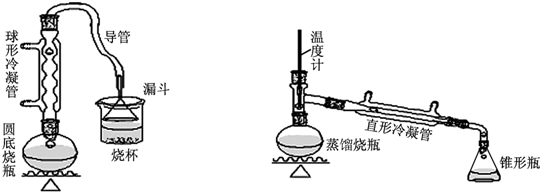
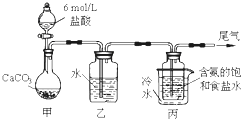
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com