
【题目】常温下,将pH=4的硫酸溶液分别稀释成原体积的10倍、100倍、10000倍。则稀释后溶液的pH分别为( )
A.5、6、8B.5、6、7C.4.7、6.7、8D.4.7、6.7、7
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法![]() 的名称为2-甲基-3,5-二乙基己烷
的名称为2-甲基-3,5-二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质
C.等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加
D.下列物质的沸点按由低到高顺序为:(CH3CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3<(CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:

下列说法错误的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
C. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
D. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为两套实验装置。
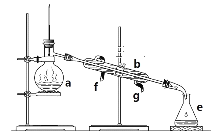
(1)写出下列仪器的名称:
a.__________________
b.__________________
(2)若利用装置I分离四氯化碳和酒精的混合物还缺少的仪器是__________,将仪器补充完整后进行实验。冷凝水由________(填f或g)口通入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、![]() 、
、![]() 、
、![]() 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
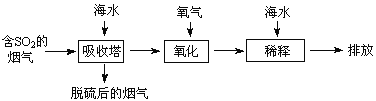
下列说法错误的是
A.海水pH约为8的原因主要是天然海水含![]() 、
、![]()
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将![]() 、SO32-、H2SO3氧化为
、SO32-、H2SO3氧化为![]()
D.经稀释“排放”出的废水中,![]() 浓度与海水相同
浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
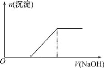
A.Na+、Fe2+、NO3-、H+都可在该物质的溶液中大量共存
B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C.向0.1molL-1该物质的溶液中逐滴滴加0.1molL-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com