
分析 ①相对分子质量与摩尔质量的数值相同、单位不同,摩尔质量的单位为g/mol;
②结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
③结合1molFe的质量为Mg计算.
解答 解:①已知NH3的相对分子质量为17,则NH3的摩尔质量为17g/mol,故答案为:17g/mol;
②NA为阿伏加德罗常数,已知ag某气体中含分子数为b,则该气体的摩尔质量为$\frac{a{N}_{A}}{b}$g/mol,故答案为:$\frac{a{N}_{A}}{b}$g/mol;
③已知一个铁原子的质量为bg,则铁原子摩尔质量为bNAg/mol,故答案为:bNAg/mol.
点评 本题考查物质的量的计算,为高频考点,把握物质的量与质量、摩尔质量、微粒数的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:实验题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | / | Zn+Fe2+=Zn2++Fe | ② |
| ③ | 在FeCl3溶液中加入足量铁粉 | ③ | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | ④ | / | / | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸的酸性最强的元素位于周期表的最右上方 | |
| B. | 所有主族元素的最高正化合价等于它的族序数 | |
| C. | X的含氧酸的酸性比Y的含氧酸的酸性强,则非金属性X>Y | |
| D. | 离子化合物熔融状态都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
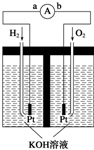 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
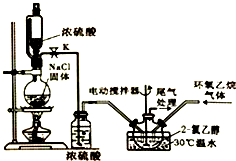 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.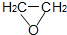 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com