


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 应取浓硫酸的体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.称取4.77gNa2CO3固体溶于水配成450mL溶液 |
| B.称取5.3gNa2CO3固体溶于水配成500mL溶液 |
| C.称取12.9gNa2CO3?10H2O固体溶于水配成450mL溶液 |
| D.量取90mL0.5mol/LNa2CO3溶液加360mL水稀释 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将10mLl8mol/LH2SO4溶液加入盛有90mL水的容量瓶中 |
| B.将10mLl8mol/LH2SO4溶液加入容量瓶中,加水至刻度线 |
| C.加水时不慎超过刻度线,倒出一些液体重新加水至刻度线 |
| D.此实验中玻璃棒有搅拌和引流的作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
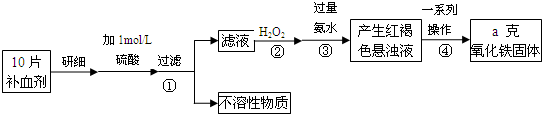
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com