
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

考点: 溶液的配制.
专题: 实验题.
分析: (1)根据配制500mL 0.1mol/L的硫酸铜溶液的步骤选用仪器,然后判断还缺少的仪器;
(2)依据n=CV,m=nM计算需要硫酸铜的质量或者五水硫酸铜的质量;
(3)根据c=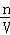 分析,不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;
分析,不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;
(4)依据玻璃棒在溶解物质时的作用解答;
(5)根据配制溶液时正确的定容方法进行解答;
(8)根据c=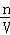 分析,不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
分析,不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
解答: 解:(1)依据配制500mL 0.1mol/L的硫酸铜溶液的步骤可知,配制过程中需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、胶头滴管、500mL容量瓶等,还缺少的仪器为:胶头滴管和500mL容量瓶,
故答案为:玻璃棒;500mL容量瓶;
(2)实验室需配制480mL0.1mol/L的CuSO4溶液,需要选用500mL容量瓶,实际上配制的是500mL 0.1mol/L的硫酸铜溶液,需要硫酸铜的物质的量为:0.1mol/L×0.5L=0.05mol,需要硫酸铜的质量:
160g/mol×0.05mol=8.0g,
需要五水硫酸铜固体的质量为:250g/mol×0.05mol=12.5g,
故答案为:AC;
(3)称量.所用砝码生锈,称取的溶质的质量偏大,溶质的物质的量偏大,溶液的浓度偏高;
故答案为:偏高;
(4)溶解固体物质,用玻璃棒搅拌可以加速固体的溶解;
故答案为:搅拌加速CuSO4•5H2O晶体溶解;
(5)配制一定物质的量浓度溶液,在移液操作中应该用玻璃棒将溶液引流入容量瓶,并洗涤烧杯2﹣3次,保证溶质全部转移到容量瓶,防止产生误差;
故答案为:引流;保证溶质全部转移到容量瓶;
(8)定容时,仰视刻度线,导致溶液的体积偏大,溶液的浓度偏低;
故答案为:偏低.
点评: 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:
某化学反应的△H=+122kJ•mol﹣1,△S=﹣231J•mol﹣1•K﹣1,则此反应在下列哪种情况下可自发进行()
A. 在任何温度下都能自发进行
B. 在任何温度下都不能自发进行
C. 仅在高温下自发进行
D. 仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL质量分数为35%、密度为1.24g/mL的硫酸中,硫酸的物质的量浓度为()
A. 0.044mol/L B. 0.44mol/L C. 4.4mol/L D. 44mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
对相同状况下的12C18O和14N2两种气体,下列说法正确的是()
A. 若质量相等,则质子数相等
B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积 相等
相等
D. 若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是()
序号 反应物 产物
① KMnO4、H2O2、H2SO4 K2SO4、MnSO4
② Cl2、FeBr2 FeCl3、FeBr3
③ MnO4﹣ Cl2、Mn2+
A. 第①组反应的 其余产物为H2O和O2
其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
C. 第③组反应中生成1mol Cl2,转移电子2mol
D. 氧化性由强到弱顺序为MnO4﹣>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 H+NH4+Al3+K+
可能大量含有的阴离子 Cl﹣Br﹣I‑ClO‑AlO2﹣
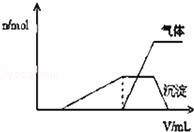
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有K+,
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积
(标准状况) 2.8L 5.6L 11.2L
n(Cl﹣) 1.25mol 1.5mol 2mol
 n(Br﹣) 1.5mol 1.4mol 0.9mol
n(Br﹣) 1.5mol 1.4mol 0.9mol
n(I﹣) a mol 0 0
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应的热现象的说法正确的是()
A. 放热反应发生时不必加热
B. 化学反应过程中一定有能量变化
C. 吸热反应需要加热后才能发生
D. 化学反应吸收或放出热量的多少与参加反应的物质的多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①H2(g)+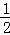 O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
②H2(g)+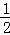 O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
③C(s)+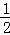 O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热△H为 .
(2)燃烧1g H2生成液态水,放出的热量为 KJ.
(3)写出CO燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1 CO(g)+ O2(g)=CO2(g)△H=﹣283kJ•mol﹣1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量.
O2(g)=CO2(g)△H=﹣283kJ•mol﹣1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com