
【题目】实验室用 63%的浓HNO3(其密度为1.4g/mL)配制240mL0.50mol/L稀HNO3,若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯
(1)此浓硝酸的物质的量浓度为_______mol/L。
(2)应量取63%的浓硝酸____mL,应选用____ (填仪器的字母编号)。
(3)实验时还需选用的仪器有D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)_____。
①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)容避瓶足专门用来配制一定体积一定浓度的溶液的仪器,以下有关容量瓶的叙述正确的有__________。
A.容量瓶上标有压强、温度、刻线
B.容量瓶不能长时间贮存试剂
C.为使实验更准确,容量瓶洗净后最好用欲配制的溶液润洗
D.用容量瓶配制溶液,容量瓶必须是干燥的
【答案】 14.0 8.9 A F、H ①③ B
【解析】(1)由公式C=![]() ,则浓硝酸的物质的量浓度为:C(HNO3)=
,则浓硝酸的物质的量浓度为:C(HNO3)= 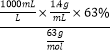 = 14.0mol/L。
= 14.0mol/L。
(2)、因无240mL的容量瓶,则根据容量瓶的规格,应配制250mL0.50mol/L稀HNO3,根据溶液稀释定律,C(浓硝酸)×V(浓硝酸)= C(稀硝酸)×V(稀硝酸),则V(浓硝酸)= 0.25L×0.50mol/L÷14.0 mol/L= 0.0089L,即8.9mL;为了减小称量误差,根据“大而近”的原则,应选择10mL的量筒。
(3)、根据溶液配制的步骤,此时还缺少250mL的容量瓶和胶头滴管,所以选F、H。
(4)、①.量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶中,会造成溶质的物质的量偏高,则物质的量浓度偏高,所以①正确;
②. 容量瓶使用时未干燥,因后续还要加水定容,所以对配制溶液无影响,②错误;
③. 溶解后未经冷却就移液,则冷却至室温时溶液体积会减小,则配制的溶液浓度偏高,所以③正确;
④. 定容时不小心有少量蒸馏水滴到瓶外,因损失的是蒸馏水,而不是溶质,根据定容的原则,可以继续加水至刻度线,所以对配制溶液的浓度无影响,所以④错误;
⑤.因为是定容以后振荡摇匀,静置,此时发现液面低于刻度线,是因为有部分溶液可能在瓶塞和瓶口结合处未能滴下,这属于正常情况,此时再加水会导致溶剂偏多,配制的溶液浓度偏低,故⑤错误。
所以此题答案为①③
(5)容量瓶上标有容积、温度和刻度线三种标识,没有压强,所以A错误;B项正确;用欲配制的溶液对容量瓶进行润洗,会造成所配制的溶液浓度偏高,故C错误;因容量瓶中含有少量水,对所配制的溶液无影响,所以D错误;此题答案为B


科目:高中化学 来源: 题型:
【题目】某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A. 该元素原子核外共有5个电子层
B. 该元素原子最外层共有3个电子
C. 该元素原子的M能层共有8个电子
D. 该元素原子处于能量最低状态时,原子中共有3个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:

回答下列问题:
(1)为检验起始滤液中的Cl,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂Ⅰ的化学式为________________,判断试剂Ⅰ已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KCl晶体的质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 己烷共有4种同分异构体,它们的熔点、沸点各不相同
B. 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C. 油脂皂化反应得到高级脂肪酸钠与甘油
D. 聚合物(![]() )可由单体CH3CH=CH2和CH2=CH2加聚制得
)可由单体CH3CH=CH2和CH2=CH2加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般情况下,前者无法决定后者的是
A. 原子核外电子排布——元素在周期表中的位置
B. 弱电解质的相对强弱——电离常数的大小
C. 分子间作用力的大小——分子稳定性的高低
D. 物质内部储存的能量——化学反应的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商品“纯净水”、“太空水”、“蒸馏水”等作为日常饮料水,因缺少某些成分而不利于少年儿童身体健康,你认为在制备上述商品饮用水时至少还需要添加微量的化学物质( )
A.钙和镁的碳酸氢盐B.含碘酸盐的食盐
C.漂白粉等消毒剂D.小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质的递变规律不正确的是
A.HCl、HBr、HI稳定性依次减弱
B.Na、Mg、Al的原子半径依次增大
C.NaOH、KOH、CsOH碱性依次增强
D.Li、Na、K、Rb、Cs单质的失电子能力逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4>O2
D.如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )

A. 水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com