
| A. | 漂白粉 | B. | 氯水 | C. | 液氯 | D. | 水玻璃 |
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 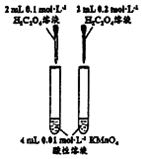 |  | 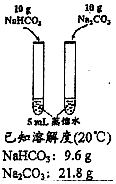 |  |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态18O的电子排布式:1s22s22p63s23p6 | |
| D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1 mol NaClO3转移6 mol电子 | |
| C. | 还原产物是NaClO3,氧化产物是NaCl | |
| D. | 被氧化的氯原子与被还原的氯原子个数比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
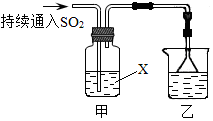
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
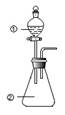 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ① | ② | 现象 |
| A | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
| B | 氯化铁溶液 | 铁氰化钾溶液 | 产生蓝色沉淀 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 无明显现象 |
| D | 偏铝酸钠 | 稀盐酸 | 立即产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com