
| A. | 密度比为1:1 | B. | 密度比为11:16 | C. | 体积比为16:11 | D. | 体积比为11:16 |
分析 同温同压下,Vm相同,结合n=$\frac{m}{M}$、V=nVm、ρ=$\frac{M}{Vm}$计算.
解答 解:等质量的SO2和CO2,物质的量之比为$\frac{m}{64}$:$\frac{m}{44}$=11:16,则
A.相同条件下,密度之比等于摩尔质量之比,为64:44=16:11,故A错误;
B.相同条件下,密度之比等于摩尔质量之比,为64:44=16:11,故B错误;
C.同温同压下,Vm相同,体积之比等于物质的量之比,为11:16,故C错误;
D.同温同压下,Vm相同,体积之间等于物质的量之比,为11:16,故D正确;
故选:D.
点评 本题考查物质的量的计算,为高频考点,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
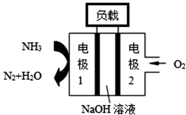 (1)已知
(1)已知查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与稀盐酸反应 O2-+2H+═H2O | |
| B. | 向碳酸氢钠溶液中滴加稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向澄清石灰水中通入少量CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写结构简式).
(写结构简式).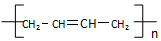 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com