
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钠与水反应:2Na+2 H2O═2Na++2 OH-+H2↑ | |
| D. | 醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
分析 A.碳酸氢钠少量,反应生成碳酸钡、氢氧化钠和水;
B.次氯酸根离子具有强的氧化性能够氧化二氧化硫生成硫酸根离子;
C.二者反应生成氢氧化钠和氢气;
D.醋酸为弱酸,部分应保留化学式.
解答 解:A.Ba(OH)2溶液与少量的NaHCO3溶液混合,离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O,故A错误;
B.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故B错误;
C.金属钠与水反应,离子方程式:2Na+2H2O═2Na++2 OH-+H2↑,故C正确;
D.醋酸与氢氧化钠溶液的反应,离子方程式:CH3COOH+OH-═H2O+CH3COO-,故D错误;
故选:C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意化学式的拆分,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 向2 mL 0.1 mol/LFeCl2溶液中滴加KSCN溶液,再滴加氯水 | |
| Ⅱ | 向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色; 滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色; 滴加KSCN溶液后,溶液变成红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol/L KI溶液中滴加 1 mL 0.1mol/L FeCl3溶液,或CCl4;或铁氰化钾溶液 | 溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 在苯甲酸重结晶实验中,在冷却结晶过程中温度越低越好 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
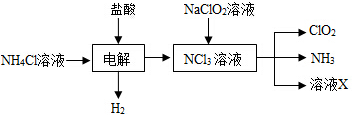
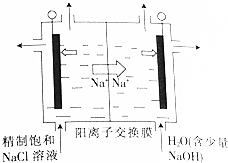
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.6 g 丙烷中所含的极性共价键为 4NA | |
| B. | 常温常压下,2.24 L 乙烯中电子总数为1.6NA | |
| C. | 溴乙烷加入NaOH溶液、加热再加入AgNO3有浅黄色沉淀生成 | |
| D. | 26克C2H2、苯、苯乙烯组成的混合物所含碳原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢的五种同位素 | B. | 五种氢元素 | ||
| C. | 氢的五种原子 | D. | 氢元素的五种不同微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热88kJ | B. | 吸热2.44 kJ | C. | 放热44kJ | D. | 吸热44 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com