
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
分析 A.根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极;
B.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;
C.在原电池中阴离子向负极移动,阳离子向正极移动;
D.若用阳离子交换膜,放电时,负极的钠离子向正极移动,产生的银离子沉淀溶液中的氯离子.
解答 解:A.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,而不是正极反应式,故A错误;
B.根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故B正确;
C.在原电池中阴离子向负极移动,阳离子向正极移动,故C错误;
D.放电时,当电路中转移0.2mole-时,负极区有0.2mol钠离子通过阳离子交换膜向正极移动,同时会有0.2molAg失去0.2mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.2mol,则负极区中共减少0.4mol离子,故D正确;
故选:BD.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.


科目:高中化学 来源: 题型:实验题
 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①②③④ | C. | 只有①②③ | D. | 只有①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
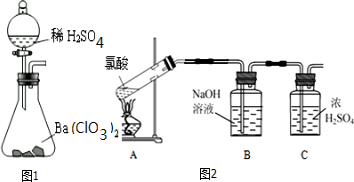
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═Na++HSO4? | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
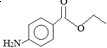 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| C. | 苯环上有2个取代基,且含有硝基的同分异构体有15种 | |
| D. | 分子式为C9H10NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 NaOH NaCl MgO | B. | H2SO4 AlCl3 CaCO3 Na2O | ||
| C. | NO2 Ba(OH)2 CaO H2O2 | D. | HBr KOH BaSO4 CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com