
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |


科目:高中化学 来源: 题型:
| A、食用纤维素、淀粉、蛋白质、脂肪和植物油都是高分子化合物 |
| B、棉花和蚕丝的主要成份都是纤维素 |
| C、蔗糖、淀粉、油脂等都可以发生水解反应 |
| D、油脂都不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
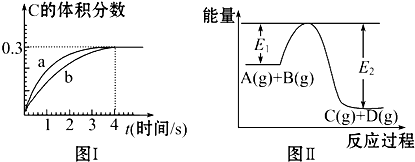
| A、反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是 0.225 mol?L-1?s-1 |
| B、该温度下,压缩气体体积至1L,反应的平衡常数增大 |
| C、恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 |
| D、在上述反应体系中加入催化剂,化学反应速率增大,则E1和E2均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5 mol?L-1?s-1 |
| B、6 mol?L-1?s-1 |
| C、2 mol?L-1?s-1 |
| D、3 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
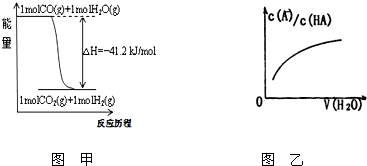 关于下列各图的叙述不正确的是( )
关于下列各图的叙述不正确的是( )| 表 丙 | |
| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2=2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.045mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表丙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24g NaH中阴离子所含电子总数为NA |
| B、1mol苯分子中含有3NA个碳碳单键 |
| C、NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D、在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com