
| n |
| V |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、K2C2O4溶液的电离方程式:K2C2O4?2K++C2O42- |
| B、制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32ˉ+2H+=CO2↑+H2O |
| C、氯化镁溶液中通入二氧化碳:Mg2++CO2+H2O═MgCO3↓+2H+ |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
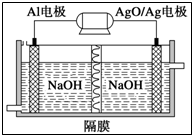 (1)现有以下物质:
(1)现有以下物质:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |
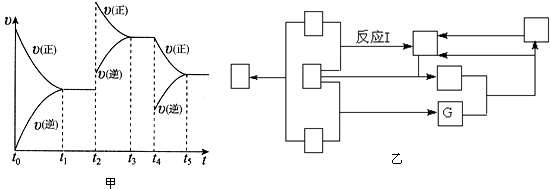
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com