
【题目】三氯化氧磷(POCl3)常用作半导体掺杂剂,实验室制取POCl3并测定产品质量的实验过程如下,据此回答下列问题:
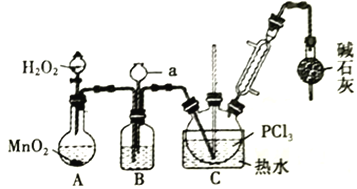
Ⅰ.氧化液态PCl3法制备POCl3:
资料i:有关试剂的性质及实验装置(加热及夹持装置省略)如下:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者均为无色液体,相互溶解;遇水均剧烈水解为两种酸。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)A 中反应时,MnO2的作用是_________________;仪器a的名称为_________________;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还有_________________;
(3)实验时应控制反应温度在60~65℃,温度不宜过高的原因是_________________;;如果撤去装有碱石灰的干燥管,则可能降低POCl3的产量,原因是_________________________________(用化学方程式表示,任写一个)。
Ⅱ.沉淀滴定法测定POCl3质量:
资料ii :Ag3PO4为黄色沉淀,易溶于硝酸;
iii:Ag++SCN-=AgSCN↓,且Ksp(AgSCN) <Ksp(AgCl)。
实验步骤如下:
①将三颈烧瓶中的产品POCl3去除杂质,溶于60.00mL蒸馏水中,搅拌使其完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.8mol/L AgNO3标准溶液;
③加入少量硝基苯,用力摇动,使沉淀表面覆盖硝基苯;
④加入2~3 滴硫酸铁溶液作指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去10,00mL KSCN溶液。
(4)达到终点时的现象是______________________________;
(5)所得产品POCl3的质量为____________(结果保留两位小数);若取消步骤③,则所得结果将______________(填“ 偏高”、“ 偏低”或“不变”)。
【答案】 作催化剂(或:起催化作用) 长颈漏斗 干燥氧气、平衡气压 避免PCl3挥发影响产物纯度 POCl3+3H2O ==H3PO4+3HCl (或:PCl3+3H2O ==H3PO3+3HCl) 溶液变红色,且半分钟内不褪色 18.42g 偏低
【解析】I.A装置中用双氧水与二氧化锰反应生成氧气,通过加入双氧水的量,可以控制产生氧气的速率,氧气中含有水蒸气用浓硫酸除去,所以B装置中装浓硫酸,装置B中有上颈漏斗,可以平衡装置内外的压强,起安全瓶的作用,纯净的氧气与三氯化磷反应生成POCl3,为了控制反应速率且要防止三氯化磷会挥发,反应的温度控制在60~65℃左右,所以装置C中用水浴,为防止POCl3挥发,用冷凝管a进行冷凝回流,POCl3遇水均剧烈水解为含氧酸和氯化氢,所以为防止空气中水蒸汽进入装置,同时吸收尾气,所以在装置的最后连有碱石灰的干燥管。
(1)A 中反应时,MnO2是催化剂;仪器a为长颈漏斗,故答案为:作催化剂;长颈漏斗;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还可以干燥氧气、平衡气压,故答案为:干燥氧气、平衡气压;
(3)实验时应控制反应温度在60~65℃,避免PCl3挥发影响产物纯度;如果撤去装有碱石灰的干燥管,POCl3+3H2O ==H3PO4+3HCl,降低了POCl3的产量,故答案为:避免PCl3挥发影响产物纯度;POCl3+3H2O ==H3PO4+3HCl;
II.测定POCl3产品含量,用POCl3与水反应生成氯化氢,然后用硝酸银标准溶液沉淀溶液中的氯离子,KSCN溶液滴定过量的AgNO3溶液,根据KSCN的物质的量可计算出溶液中剩余的AgNO3,结合AgNO3的总物质的量得知与氯离子反应的硝酸银,进而计算出溶液中氯离子的物质的量,根据元素守恒可计算出样品中POCl3的质量。
(4)以硫酸铁溶液为指示剂,用KSCN溶液滴定过量的AgNO3溶液达到终点时的现象是溶液变红色,且半分钟内不褪色,故答案为:溶液变红色,且半分钟内不褪色;
(5)KSCN的物质的量为0.2mol/L×0.01L=0.002mol,根据反应Ag++SCN-=AgSCN↓,可知溶液中剩余的银离子的物质的量为0.002mol,POCl3与水反应生成氯化氢的物质的量为(3.8 mol/L×0.01L-0.002mol)×![]() =0.36mol,产品中POCl3的物质的量为0.12mol,质量为0.12mol×153.5g/mol=18.42g,加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN,已知Ksp(AgCl)>Ksp(AgSCN),使得实验中消耗的AgSCN偏多,根据计算原理可知,会使测定结果将偏低,故答案为:18.42g;偏低。
=0.36mol,产品中POCl3的物质的量为0.12mol,质量为0.12mol×153.5g/mol=18.42g,加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN,已知Ksp(AgCl)>Ksp(AgSCN),使得实验中消耗的AgSCN偏多,根据计算原理可知,会使测定结果将偏低,故答案为:18.42g;偏低。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】实验室保存下列物质的方法中,不正确的是
A.少量金属钠保存在煤油中
B.浓硫酸保存在敞口试剂瓶中
C.FeSO4溶液保存在加有少量铁粉的试剂瓶中
D.硝酸装在棕色试剂瓶中密封避光保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮益酸类化合物K具有抗菌、消炎的作用,合成路线设计如下图所示:

已知部分有机化合物转化的反应式如下:
ⅰ. ![]() (R为烃基)
(R为烃基)
ⅱ. ![]() (R、R代表烃基或氢)
(R、R代表烃基或氢)
ⅲ.  (R代表烃基或氢)
(R代表烃基或氢)
请回答:
(1)A的结构简式_______,其核磁共振氢谱吸收峰面积比为________。
(2)F的结构简式_______,C→D的反应类型为_______。
(3)G与试剂b反应的化学方程式为______________。
(4)满足下列条件D的同分异构体共有_____种。
①能发生银镜反应 ②分子中含有酯基 ③苯环上有两个取代基
写出符合上述条件且苯环上的一氯取代物只有两种的同分异构体的结构简式______。
(5)以A 和乙烯为起始原料,结合题中信息,选用必要的无机试剂设计出合成苯乙酸乙酯(![]() )的简单流程图______。(无机试剂任选)
)的简单流程图______。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g),达到限度后,欲提高一氧化碳的转化率,可以采取的措施为( )
CO2(g)+H2(g),达到限度后,欲提高一氧化碳的转化率,可以采取的措施为( )
A. 使用催化剂 B. 增大压强
C. 增大一氧化碳的浓度 D. 增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:___________________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。

(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,则燃料电池中理论上消耗CH4的体积(标准状况)为_________________。
(4)25℃时,H2CO3的电离常数分别为:Ka1=4.4×10-7mol·L-1;Ka2=5.0×10-11 mol·L-1。在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,所得溶液pH=8。此溶液中各阴离子的物质的量浓度大小关系为__________________,![]() =__________________。
=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的成分主要为FeCr2O4,另含有少量Al2O3和SiO2。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
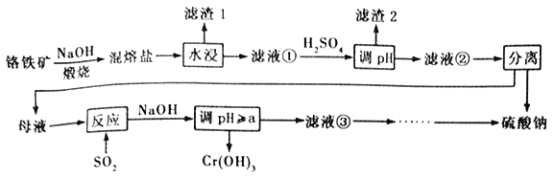
已知“混熔盐”中含有Na2CrO4和NaFeO2,其中NaFeO2极易水解。试回答下列问题:
(1)“滤渣1”为红褐色沉淀,其化学式为_________________;向滤液①中加H2SO4“调pH”的目的:一是使CrO42-转化为Cr2O72- ;二是____________________________。
(2)“煅烧”铬铁矿时,主要反应的化学方程式为_______________________________。
(3)根据右图溶解度(S)~温度(T)曲线判断,对滤液②进行的最佳“分离”方法为_________(填序号)。
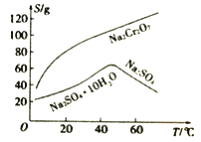
A.蒸发结晶 B.蒸发浓缩,趁热过滤 C.蒸发浓缩,冷却结晶,过滤
(4)“反应”的离子方程式为_______________________________。
(5)Cr(OH)3溶于盐酸生成配离子[CrCln(H2O) 6-n]x+。0.0015 mol [CrCln(H2O) 6-n]x+与氢离子交换树脂(HR)完全发生离子交换:
[CrCln(H2O) 6-n]x++xHR→Rx[CrCln(H2O) 6-n]+xH+,生成的H+可与25.00 mL0.1200 mol·L -1NaOH溶液恰好中和。则该配离子的化学式为__________________。
(6)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+) =1.0×10-5 mol·L -1时,应调节溶液pH的最小值a为多少? (列式计算)____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对含量进行测定. 
(1)仪器A的名称是 .
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2 , 然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 .
(4)若滴定终点时溶液的pH=8.8,则选择的指示剂为 .
(5)该测定结果往往比实际值偏高,分析是由于采用试剂不当引起的,可能的原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,几种常见弱电解质的电离平衡常数如下表所示:
电解质 | H3PO4 | NH3·H2O | C6H5OH |
电离平衡常数 | K1=7.5×10-3 K2=7.5×10-8 K3=7.5×10-13 | 1.7×10-5 | 1.1×10-10 |
下列说法正确的是
A. NaH2PO4溶液呈碱性
B. 25℃时,0.1moL/L氨水的pH=11+lg1.7
C. 足量C6H5OH与Na3PO4反应的离子方程式为:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液中各离子浓度关系:c(C6H5O-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com