
青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是 ( )
A.青石棉是一种硅酸盐材料
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使1 mol HNO3被还原
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
碳的燃烧热为393.5 kJ/mol,下列热化学方程式正确的是
A.C(s)+O2(g)=CO2(g) △H = + 393.5 kJ/mol
B.C(s)+1/2O2(g)=CO(g) △H = - 393.5 kJ/mol
C.C + O2 = CO2 △H = - 393.5 kJ/mol
D.C(s)+O2(g)=CO2(g) △H = - 393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出 a kJ的热量。
(1) 写出肼和过氧化氢的电子式:肼: ,过氧化氢: ;
(2) 写出该反应的热化学方程式: ;
(3) 已知H2O(1)==H2O(g) △H= + b kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于SiO2和CO2的说法中正确的是 ( )
A.CO2、SiO2分别是碳酸和硅酸的酸酐
B.CO2和SiO2与水反应分别生成相应的酸
C.CO2是酸性氧化性,SiO2是两性氧化物
D.CO2和SiO2都是由相应的分子组成的
查看答案和解析>>
科目:高中化学 来源: 题型:
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出 来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。

下列有关该方法的叙述中正确的是 ( )
①能耗大是该方法的一大缺点
②整个过程中,只有一种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
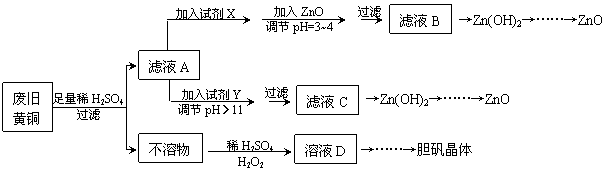

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
⑴试剂X可能是__________,其作用是____________________。
⑵加入ZnO调节pH=3~4的目的是____________________。
⑶由不溶物生成溶液D的化学方程式为______________________________。
⑷由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
⑸下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
⑹测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I- 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”
或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
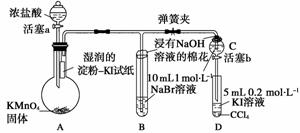
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是______________________________________。
(2)验证氯气的氧化性强于碘的实验现象是__________________________________。
(3)B中溶液发生反应的离子方程式是______________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_________________________
________________________________________________________________________。
(5)过程Ⅲ实验的目的是_______________________ ___________________________。
___________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________________,得电子能力逐渐减弱。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com