
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
分析 (一)①无色溶液,说明不含Cu2+,加入稀硫酸产生气体,说明含有碳酸根,则溶液中不能有钡离子;
②另取100ml溶液滴加足量Ba(NO3)2溶液,产生白色沉淀为硫酸钡,证明溶液中含硫酸根;
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体为氨气,证明溶液中含铵根,再通过定量计算,根据溶液呈电中性判断溶液中其他离子;
(二)(1)氯离子与银离子结合成氯化银白色沉淀;氢离子与碳酸氢根反应生成二氧化碳气体;
(2)氯水溶液中含有H+呈酸性,还含有次氯酸,具有强氧化而漂白;
(3)氯气将碘单质置换出来.
解答 解:(一)①无色溶液,说明不含Cu2+,加入稀硫酸产生气体,说明含有碳酸根,则溶液中不能有钡离子;
②另取100ml溶液滴加足量Ba(NO3)2溶液,产生白色沉淀为硫酸钡,证明溶液中含硫酸根;
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体为氨气,证明溶液中含铵根;
加稀硫酸产生二氧化碳0.224L(标况下),则n(CO32-)=n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol;
滴加足量Ba(NO3)2溶液,产生4.2g硫酸钡,则n(SO42-)=n(BaSO4)=$\frac{4.2g}{233g/mol}$=0.018mol;
向②中的溶液滴加足量NaOH溶液并加热,产生氨气0.672L(标况下),则n(NH4+)=n(NH3)=$\frac{0.672L}{22.4L/mol}$=0.03mol;
根据电荷守恒,已确定的阴离子所带负电荷:0.01mol×2+0.018mol×2=0.056mol,已确定的阳离子所带正电荷:0.03mol,溶液呈电中性,所以溶液中一定含有另一种阳离子钾离子,阴离子氯离子不能确定.
(1)由上述分析可知溶液中肯定存在的离子是:CO32-、SO42-、NH4+、K+,故答案为:CO32-、SO42-、NH4+、K+;
(2)由上述分析可知溶液中不存在的离子是:Cu2+,Ba2+,故答案为:Cu2+,Ba2+;
(3)由上述分析可知不能确定是否存在氯离子,将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,
故答案为:Cl-;将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子;
(二)(1)加入硝酸银生成的是AgCl沉淀,可证明氯水中含有Cl-;加入足量碳酸氢钠溶液,产生气体,是氢离子与碳酸氢根反应生成二氧化碳气体,证明氯水中含氢离子,故答案为:氯水中含有Cl-;氯水中含有H+;
(2)氯水溶液中含有H+,呈酸性,紫色石蕊变红,氯水中含有含有次氯酸,具有强氧化性而漂白,则可观察到溶液褪色,
故答案为:紫色石蕊先变红后褪色;
(3)检验氯水中含有Cl2,将氯水滴在淀粉-KI试纸上,有碘单质生成,试纸变蓝,发生离子反应:Cl2+2I-=2Cl-+I2,
故答案为:Cl2+2I-=2Cl-+I2.
点评 本题考查了常见离子的检验方法以及氯水的成分,题目难度中等,明确常见离子的性质为解答关键,注意掌握电荷守恒在离子推断中的应用方法,试题注重于学生实验能力和探究能力的考查.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
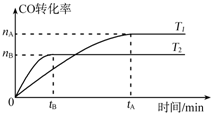 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
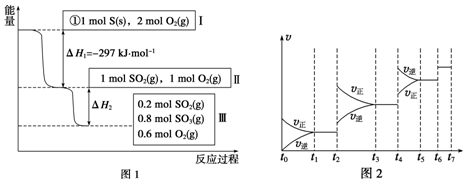
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的消耗速率与B的生成速率相等 | |
| B. | 单位时间内消耗3a mol C,同时生成a mol A | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②①⑤ | B. | ④⑤③②① | C. | ④③①②⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通过Na2O2粉末后固体物质质量增加 | |
| B. | 在NaClO溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| C. | Na2S溶液在空气中长期放置变浑浊的离子方程式为2S2-+O2+4H+=2S↓+2H2O | |
| D. | NH4HCO3溶液中滴加足量NaOH溶液的离子方程式为HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com