
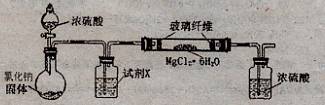
 后,过滤;
后,过滤;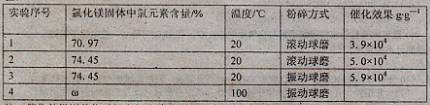
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:不详 题型:单选题
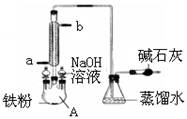
| A.左侧的分液漏斗中加入的是苯和溴水 |
| B.仪器A的名称叫蒸馏烧瓶 |
| C.锥形瓶中的导管口出现大量白雾 |
| D.碱石灰作用是防止空气中水蒸气进入反应体系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
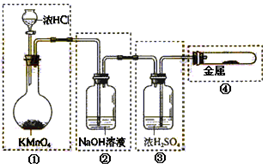
| A.只有①和②处 |
| B.只有②处 |
| C.只有②和③处 |
| D.只有②、③、④处 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
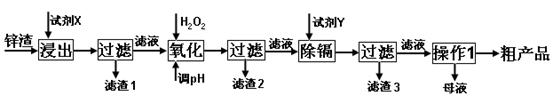
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
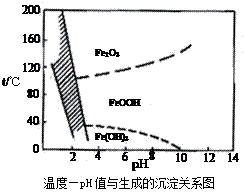
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
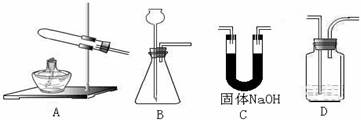
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.取100mL5mol/ LH2SO4,加入400mL水 LH2SO4,加入400mL水 |
| B.取200mL5mol/LHCl,加水稀释至500mL |
C.取100 mL 5mol/LH2SO4,加500mL水稀释 5mol/LH2SO4,加500mL水稀释 |
| D.取100 mL5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com