
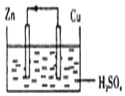
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
分析 A.构成原电池正负极的材料不一定是两种金属;
B.锌比铜活泼,锌为负极;
C.电子只能经过外电路,溶液中由离子定向移动导电;
D.根据锌和转移电子之间的关系式计算.
解答 解:A.构成原电池正负极的材料不一定是两种金属,可能是金属和导电的非金属,如石墨,故A错误;
B.锌比铜活泼,锌为负极,铜为正极,故B错误;
C.电子只能经过外电路,溶液中由离子定向移动导电,故C错误;
D.铜、锌原电池工作时,若有13g锌被溶解,电路中通过的电子=$\frac{13g}{65g/mol}$×2=0.4mol,故D正确.
故选D.
点评 本题考查了原电池原理,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,明确原电池的构成、电极上发生的反应、电流的流向即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 容器内H2O(g)、CO、H2物质的量相等 | B. | 容器内气体的密度不再改变 | ||
| C. | 生成n mol CO的同时生成n mol H2 | D. | v正(H2O)=v正(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
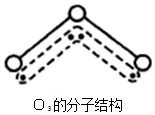 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能呈酸性 | B. | X溶液可能呈中性 | C. | Y溶液可能呈中性 | D. | Y溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中必含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10 NA | |
| B. | 22.4 LC02中含有共价键数目4 NA | |
| C. | 若H2O2分解产生成0.1mol氧气转移的电子数为0.2 NA | |
| D. | 同温、同压同体积的CO和NO含有的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com