
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()
A. 处理过程中银器一直保持恒重
B. 银器为正极,Ag2S被还原生成单质银
C. 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D. 黑色褪去的原因是黑色Ag2S转化为白色AgCl
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: 铝、银和电解质溶液构成原电池,铝作负极,银作正极,负极上铝失电子发生氧化反应,正极上银离子得电子发生还原反应,据此分析解答.
解答: 解:A.银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银,所以银器质量减小,故A错误;
B.银作正极,正极上Ag2S得电子作氧化剂,在反应中被还原生成单质银,故B正确;
C.Al2S3在溶液中不能存在,会发生双水解反应生成H2S和Al(OH)3,故C错误;
D.黑色褪去是Ag2S转化为Ag而不是AgCl,故D错误;
故选B.
点评: 本题考查原电池原理,明确正负极上得失电子是解本题关键,难度不大.


科目:高中化学 来源: 题型:
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后()
A. 整个溶液变紫色 B. 整溶液变为棕黄色
C. 上层为无色下层为紫红色 D. 下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是()
序号 反应物 产物
① KMnO4、H2O2、H2SO4 K2SO4、MnSO4
② Cl2、FeBr2 FeCl3、FeBr3
③ MnO4﹣ Cl2、Mn2+
A. 第①组反应的 其余产物为H2O和O2
其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
C. 第③组反应中生成1mol Cl2,转移电子2mol
D. 氧化性由强到弱顺序为MnO4﹣>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应的热现象的说法正确的是()
A. 放热反应发生时不必加热
B. 化学反应过程中一定有能量变化
C. 吸热反应需要加热后才能发生
D. 化学反应吸收或放出热量的多少与参加反应的物质的多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,下列关于此燃料电池的有关说法中错误的是()
A. 通过甲烷的电极X为电池的负极,通过氧气的电极Y为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①H2(g)+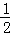 O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
②H2(g)+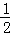 O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
③C(s)+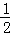 O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热△H为 .
(2)燃烧1g H2生成液态水,放出的热量为 KJ.
(3)写出CO燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是()
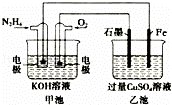
A. 甲池中负极上的电极反应式为N2H4﹣4e﹣=N2+4H+
B. 乙池中石墨电极上发生的反应为4OH﹣﹣4e﹣=2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是()
A. 已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6 kJ•mol﹣1,则氢气的燃烧热为241.8 kJ•mol﹣1
B. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量
C. 己知2C(s)+2O2(g)=2CO2(g )△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b
)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b
D. 已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
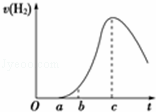
将在空气中久置的铝片与0.5mol•L﹣1硫酸反应,产生氢气的速率与反应时间可用如图所示的曲线表示,试回答下列问题.
(1)曲线O→a段不产生氢气的主要原因是(用有关化学方程式表示): .
(2)曲线b→c段产生氢气的速率增加较快的主要原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com