
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 反应物的总能量低于生成物的总能量时,发生吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
分析 A.化学反应能量变化有热能、光能、电能、机械能等多种;
B.反应热与反应的途径无关,只与反应的始态与终态有关;
C.反应物的总能量低于生成物的总能量时,发生的是吸热反应;
D.反应的热效应只与始态、终态有关,与过程无关.
解答 解:A.化学反应中的能量变化可表现为热能、光能、电能、机械能等多种,故A错误;
B.反应热与反应的途径无关,只与反应的始态与终态有关,所以应用盖斯定律,可计算某些难以直接测量的反应焓变,故B正确;
C.当反应物的总能量低于生成物的总能量时,反应后能量增大,所以反应是吸热反应,故C错误;
D.反应的热效应只与始态、终态有关,与过程无关,所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故D正确.
故选A.
点评 本题考查了反应热与反应物、生成物总能量之间的关系,反应热取决于反应物与生成物总能量的相对大小,当反应物的总能量大于生成物的总能量,该反应就放热,否则吸热,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2中只含有离子键 | B. | HCl分子中含有离子键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
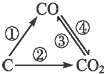 随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).
随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用20mL 18mol/L的H2SO4实验 | B. | 反应物中加入少量的硝酸钠固体 | ||
| C. | 反应物中加入少量的硫酸铜固体 | D. | 反应物中加入少量的碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:碘化氢>溴化氢>氯化氢 | B. | 氧化性:K+<Na+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 原子半径:钠>硫>氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
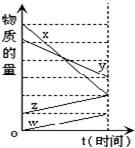 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )| A. | 4x+2y=z+w | B. | 6x+5y=4z+w | C. | 3w+z=4x+2y | D. | 2x+y=2z+2w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (取代反应)
(取代反应)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
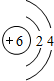 ,C、D、E中原子半径最大的为Na.
,C、D、E中原子半径最大的为Na.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com