
【题目】(1)25°C时,CH3COOH和NH3H2O的电离常数相等。取10mL0.1molL-1醋酸溶液测得其pH=3。 0.1molL-1氨水(NH3H2O溶液)的pH=_________。用pH试纸测定该氨水pH的操作方法为_______。
(2)某温度(t°C)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的KW=_________。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性,且a+b=12, 则Va: Vb_________。
(3)25°C时,0.1 molL-1的HA溶液中![]() 。请回答下列问题:
。请回答下列问题:
①HA是_________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
【答案】11 将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值 1×10-13 10:1 弱电解质 bd
【解析】
(1)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L;结合pH试纸测定溶液pH的基本操作要点回答;
(2)该溶液中c(H+)=10-11mol/L、c(OH-)=0.01mol/L,Kw=c(H+).c(OH-);混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-);
(3)①25℃时,0.1mol/L的HaA溶液中 =1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离;
=1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离;
②该酸是弱酸,加水稀释促进电离,但其电离增大程度小于溶液体积增大程度,导致溶液中c(H+)减小,温度不变,水的离子积常数不变。
(1)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,溶液PH=11,pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
(2)该溶液中c(H+)=10-11mol/L、c(OH-)=0.01mol/L,Kw=c(H+).c(OH-)=10-11×0.01=1×10-13,该温度下,pH=a的NaOH溶液中c(OH-)=10a-13,pH=b的H2SO4溶液c(H+)=10-bmol/L,
混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),且a+b=12,则c(OH-)=10a-13×Va=10-b×Vb L,Va:Vb=10:1;
(3)①25℃时,0.1mol/L的HA溶液中 =1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离,则该酸是弱电解质;
=1010,该溶液中c(H+)c(OH-)=1×10-14,则该溶液中c(H+)=0.01mol/L<0.1mol/L,说明该酸部分电离,则该酸是弱电解质;
②a.该酸是弱酸,加水稀释促进电离,则溶液中c(HA)减小,故a错误;
b.加水稀释促进该酸电离,溶液中氢离子物质的量增大、酸的物质的量减小,则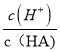 增大,故b正确;
增大,故b正确;
c.温度不变,水的离子积常数不变,则c(H+)与c(OH-)的乘积不变,故c错误;
d.温度不变,水的离子积常数不变,因为加水稀释虽然促进酸电离,但酸电离增大程度小于溶液体积增大程度,导致溶液中氢离子浓度减小,则c(OH-)增大,故d正确;
故答案为bd。


科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐类水解程度的大小可用“水解度”来表示,NaA型盐的水解度为已水解的离子的物质的量占该离子原来总物质的量的百分数。常温下10.0 mL 0.040 mol·L-1 NaOH溶液与20.0 mL 0.020 mol·L-1的某一元弱酸HA恰好完全中和,所得溶液pH为10(假设溶液的体积变化忽略不计),则所得NaA溶液的水解度为
A.1.0%B.0.75%C.0.50%D.0.25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是__________。

A.混合气体的颜色变浅,量筒中液面上升
B.量筒内壁上出现的油状液滴,应是三氯甲烷、四氯甲烷的混合物
C.水槽中有白色固体物质析出
D.甲烷与氯气反应后的产物只有CCl4
Ⅱ.根据烯烃的性质回答下列问题。
(1)一瓶无色气体,可能含有CH4和CH2=CH2或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?___________。
②上述实验可能涉及的反应类型有_____。
(2)含有 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由 聚合而成的,其化学方程式是___________________。
聚合而成的,其化学方程式是___________________。
②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________(写结构简式)聚合而成的。
),它是由________(写结构简式)聚合而成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若平衡浓度符合下列关系式:![]() ,则此时的温度为1 000 °C
,则此时的温度为1 000 °C
D.在1L的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830°C,此时测得CO为0.4 mol,则该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式属于盐的水解,且书写正确的是
A. FeCl3溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. NaHS溶液:HS-+H2O![]() H2S+OH-
H2S+OH-
C. Na2CO3溶液:![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl溶液:![]() +H2O===NH3·H2O+H+
+H2O===NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究补铁口服液中铁元素的价态,并测定该补铁口服液中铁元素的含量是否达标。
![]()
(1)实验一:探究补铁口服液中铁元素的价态。
甲同学:取1 mL补铁口服液,加入K3[Fe(CN)6](铁氰化钾)溶液,生成蓝色沉淀,证明该补铁口服液中铁元素以Fe2+形式存在。
乙同学:取5 mL补铁口服液,滴入10滴KSCN溶液无现象,再滴入10滴双氧水,未见到红色。乙同学为分析没有出现红色实验现象的原因,将上述溶液平均分为3份进行探究:
原因 | 实验操作及现象 | 结论 | ||
1 | 其他原料影响 | 乙同学观察该补铁口服液的配料表,发现其中有维生素C,维生素C有还原性,其作用是①______ | 取第1份溶液,继续滴入足量的双氧水,仍未见红色出现 | 排除②_________影响 |
2 | 量的原因 | 所加③________溶液(写化学式)太少,二者没有达到反应浓度 | 取第2份溶液,继续滴加该溶液至足量,仍然未出现红色 | 说明不是该溶液量少的影响 |
3 | 存在形式 | 铁的价态是+3价,但可能不是以自由离子Fe3+形式存在 | 取第3份溶液,滴加1滴稀硫酸,溶液迅速变为红色 | 说明Fe3+以④_______形式存在,用化学方程式结合文字,说明加酸后迅速显红色的原因 |
(2)甲同学注意到乙同学加稀硫酸变红后的溶液,放置一段时间后颜色又变浅了,他分析了SCN-中各元素的化合价,然后将变浅后的溶液分为两等份:一份中滴人KSCN溶液,发现红色又变深;另一份滴入双氧水,发现红色变得更浅,但无沉淀,也无刺激性气味的气体生成。根据实验现象,用离子方程式表示放置后溶液颜色变浅的原因________。
(3)实验二:测量补铁口服液中铁元素的含量是否达标。
该补铁口服液标签注明:本品含硫酸亚铁(FeSO4·7H2O)应为375~425(mg/100 mL),该实验小组设计如下实验,测定其中铁元素的含量。(说明:该实验中维生素C的影响已排除,不需要考虑维生素C消耗的酸性KMnO4溶液)
①取该补铁口服液100 mL,分成四等份,分别放入锥形瓶中,并分别加入少量稀硫酸振荡;
②向 ________式滴定管中加入0.002 mol.L-l酸性KMnO4溶液,并记录初始体积;
③滴定,直至溶液恰好_____________且30秒内不褪色,记录末体积;
④重复实验。根据数据计算,平均消耗酸性KMnO4溶液的体积为35.00 mL。计算每100 mL该补铁口服液中含铁元素__________mg(以FeSO4·7H2O的质量计算),判断该补铁口服液中铁元素含量___________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为:
 ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是
A. 分子式为![]() B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol
B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol![]() D. 与溴的
D. 与溴的![]() 溶液反应生成的产物经水解、稀硝酸化后可用
溶液反应生成的产物经水解、稀硝酸化后可用![]() 溶液检验
溶液检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com