
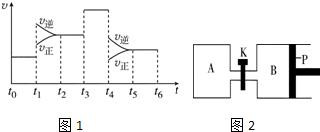
| A. | 正反应速率和逆反应速率都增大,平衡向逆反应方向移动 | |
| B. | 正反应速率和逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | ||
| C. | 恒温恒容通入氢气 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质跟浓盐酸作用时呈黄色 | |
| B. | 聚乙烯塑料制品可用于食品的包装,而聚氯乙烯不能用于食品包装 | |
| C. | 木糖醇(C5H12O5)是一种甜味剂,与葡萄糖互为同系物 | |
| D. | 将一小块钠加入乙醇中,钠浮于乙醇上,缓慢反应生成氢气,说明乙醇中羟基上的氢原子相对于水不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
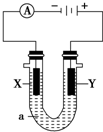 X、Y都是惰性电极,a是饱和NaCl溶液.
X、Y都是惰性电极,a是饱和NaCl溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油可作护肤保湿剂 | |
| B. | 无水氯化钙可用作食品干燥剂 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
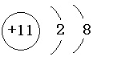 ,在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是Fe,所形成的氧化物中适宜做耐火材料的元素是Al;
,在Na、Al、Fe三种金属元素中,其所形成氧化物种类最多的元素是Fe,所形成的氧化物中适宜做耐火材料的元素是Al;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
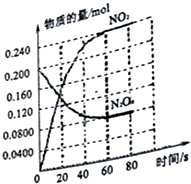 在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:
在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com