
| A、a>b | B、a=b |
| C、a<b | D、无法确定 |
| 2.3g×44 |
| 46 |
| 2.4g×22 |
| 2.4g |


科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=2x=y | ||
B、n=
| ||
| C、n=x=2y | ||
| D、x=2n=y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
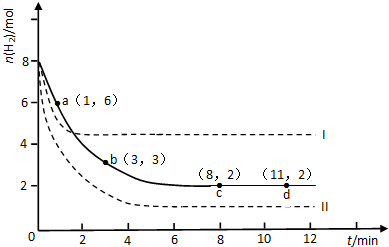
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com