
向5 mL 18 mol/L的硫酸中加入足量铜片并加热使其充分反应,下列说法正确的是( )
A.有0.09 mol的硫酸被还原
B.有0.045 mol的硫酸被还原
C.充分反应后体系无硫酸剩余
D.消耗的铜的质量一定小于2.88 g
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练6-1练习卷(解析版) 题型:选择题
在298 K、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750 mL中充分反应,
测得反应放出x kJ的热量。已知该条件下,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=(4x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-1练习卷(解析版) 题型:选择题
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
A.Y和Z可以组成一种Y和Z的质量比为7∶8的化合物
B.X、Y、Z可以组成一种盐
C.X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物
D.由X、Y、Z三种元素中的任意两种组成的10电子微粒有2种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-4练习卷(解析版) 题型:选择题
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被溶液充满,关于原来试管中盛装的气体不正确的猜测是( )
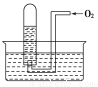
A.可能是N2与NO2的混合气体
B.可能是O2与NO2的混合气体
C.可能是NO与NO2的混合气体
D.可能是NO2一种气体
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-3练习卷(解析版) 题型:实验题
一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组分别从定性和定量两方面对此作了研究。
定性实验:按图组装好实验装置,微热试管A,观察实验现象。反应开始后,观察到A试管中Zn与浓硫酸反应,C、D、E中有气泡产生,随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失。反应较长时间后,C、D、E中的气泡量又会明显增加。试回答下列问题:
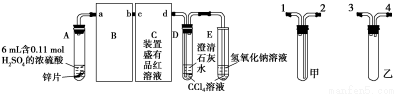
(1)从甲、乙装置选择合适的填入B、C中,并进行正确连接,a接 、 接b,c接 、 接d;D、E两支试管中CCl4的作用是 。
(2)能证明浓硫酸具有强氧化性的实验现象为 ;反应较长时间后气泡量又会明显增加的原因是 。
(3)一定量的浓硫酸与足量Zn充分反应时,有H2生成的理由是 ;实验过程中,浓硫酸表现强氧化性的反应方程式是 。D中浑浊消失的离子反应方程式是 。
定量实验:某化学实验研究性学习小组设计了以下实验,以定量测定反应中生成的SO2和H2的体积之比。
取A试管中充分反应后的溶液2 mL(假设反应前后溶液的体积不变),配制成100 mL溶液。然后取稀释液20.00 mL滴加BaCl2溶液使沉淀完全,过滤、洗涤、干燥沉淀,称量所得沉淀为1.4 g。
(4)完成定量实验部分所需的玻璃仪器有:滴管、玻璃棒、烧杯、量筒、干燥器、 、 、 、 、 等(可填满,也可以空缺)。
(5)计算反应中生成的SO2和H2的体积之比: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-3练习卷(解析版) 题型:选择题
实验室有一瓶久置的白色K2SO3粉末,元素分析表明该粉末中K和S元素的质量比为39∶16,下列结论正确的是( )
A.根据元素分析结果推测该粉末为纯净物
B.将该粉末溶于水,加入氯化钡,有白色沉淀生成,证明该粉末中含有K2SO4
C.将该粉末加入盐酸中,产生气泡,证明该粉末是K2SO3粉末
D.将该粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明该粉末是K2SO4和K2SO3的混合物
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-2练习卷(解析版) 题型:填空题
A~G各物质间的关系如图,其中B、D为气态单质。
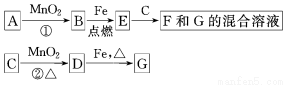
请回答下列问题。
(1)物质C和E的名称分别为 、 ;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为 ;若只能在加热情况下进行,则反应物A应为 ;
(3)MnO2在反应①和反应②中的作用分别是 、 ;
(4)新配制的F溶液应加入 以防止其转化为G。检验G溶液中阳离子的常用试剂是 ,实验现象为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-1练习卷(解析版) 题型:选择题
将足量CO2通入下列溶液中,所含离子还能大量共存的是( )
A.K+、SiO32-、Cl-、NO3-
B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42-
D.Na+、CO32-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-2练习卷(解析版) 题型:选择题
在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是( )
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com