
【题目】某原料药合成路线如下:
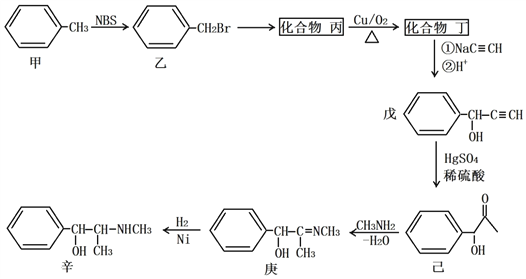
(1)甲→乙的反应类型为_______________;乙→丙的反应条件为__________________。
(2)丁的名称为_______________;戊的分子式为__________________。
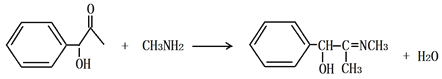
(3)丁发生银镜反应的化学方程式为___________________________________________;己→庚的化学方程式为___________________________________________。
(4)化合物己的芳香族同分异构体有多种,A和B是其中的两类,它们的结构和性质如下:
①已知A遇FeC13溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则A的结构简式可能为________________或________________。
②已知B中含有甲基,能发生水解反应,苯环上只有一个取代基,则B的结构有___种。
(5)丁烯酮(![]() )可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
)可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
合成路线流程图示例如:A ![]() B……
B……![]() 目标产物。
目标产物。
【答案】 取代反应 NaOH水溶液,加热 苯甲醛 C9H8O 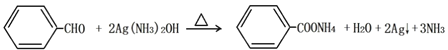

 5
5  或:
或:
【解析】(1)甲→乙的反应中,Br取代了H原子,反应类型为取代反应;乙→丙的反应为卤代烃的水解反应,反应条件为NaOH,加热;
(2)丙为苯甲醇,催化氧化作用下生成丁:苯甲醛;戊的结构式中,苯环分子式为C6H6,其中一个H被C3H3O代替,故分子式为C9H8O;
(3). 银镜反应为醛基化合物与氢氧化二氨银在加热条件下生成银单质的反应,苯甲醛的银镜反应为: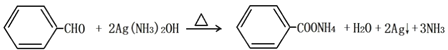 ;
;
H2N-CH3与己脱去H2O分子生成庚,己结构中的O脱去,形成C=N,化学方程式为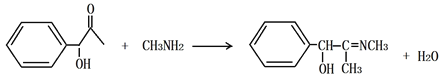 ;
;
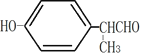
(4)①A中含有酚羟基和醛基,所以A的结构可能是在酚羟基的对位存在-CH2CH2CHO,和CHCH3CHO,即结构是为: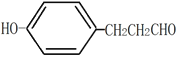 ,
, ;
;
②取代基中含有酯基和甲基,其可能形式为:-COOCH2CH3、-CH2COOCH3、-OOCCH2CH3、-CH2OOCCH3、-CHCH3OOCH,所以可能结构有5种;
(5)倒推:丁烯酮![]() 中CH2=CH-可由CH3-CHOH-发生消去反应生成,CH3-CHOH-CO-CH3类似于已知条件中己的结构,由此可得:
中CH2=CH-可由CH3-CHOH-发生消去反应生成,CH3-CHOH-CO-CH3类似于已知条件中己的结构,由此可得:
由类似于戊的物质CH3-CHOH-C≡CH在一定条件下生成类似于己的物质CH3-CHOH-CO-CH3,进而生成丁烯酮的反应流程为: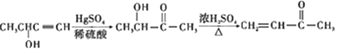
参考已知中丁生成戊的反应,乙醛CH3-CHO与乙炔钠(NaC≡CH)在酸性条件下生成戊,乙醛可由乙烯催化氧化得到,所以整体反应流程为:



 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol 电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子都达到了8e-稳定结构,该分子的电子式为____________,化学键类型为________________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2LNO与11.2 LO2混合后所含分子数为0.75NA
B. 常温常压下,16gO3所含电子数为8NA
C. 1L0.lmol·L-1Al2(SO4)3溶液中Al3+的数目为0.2NA
D. 铝和氢氧化钠溶液反应生成1mol H2时,转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).

(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一组检验氯气性质的装置。
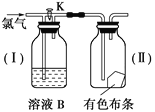
(1)现关闭活塞K,若有色布条是干燥的,溶液B为浓硫酸,则有色布条________;若溶液B为水,则有色布条________;若溶液B为饱和的NaHCO3溶液,则有色布条________。
(2)现打开K,溶液B为氢氧化钠溶液,通入的Cl2是湿润的,布条是干燥的,则有色布条________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属钠和镁等,其流程如图所示。
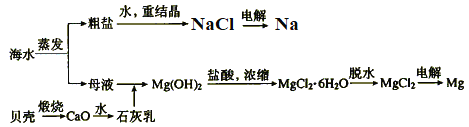
下列说法正确的是
A. 电解NaCl溶液可得到金属钠
B. 上述过程中发生了分解、化合、置换、复分解反应
C. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++2OH-=Mg(OH)2↓
D. 不用电解MgO来制取镁是因为MgO的熔点比MgCl2的高,能耗大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com